苯胺是橡胶助剂、医药磺胺药及生产农药的重要原料,苯胺的化学式为C6H5NH2.苯胺对环境有危害,对水体可造成污染,会引起人体高铁血红蛋白血症、溶血性贫血和肝、肾损害.请根据苯胺的化学式,回答下列问题:
(1)苯胺是由 种元素组成。
(2)苯胺中C、H、N元素的质量比 。
(3)苯胺中碳元素的质量分数是 (结果保留到0.1%)。
将“先”与“后”填入下列空格内。
(1)用盐酸中和氢氧化钠溶液时,________滴加几滴酚酞试液,__________滴加盐酸。
(2)稀释浓硫酸时,向烧杯内_________加水,___________加浓硫酸。
(3)不慎将较多量浓碱溶液泼洒在实验台上,应该_______用水冲洗,_________用适量的稀醋酸中和。
(4)称取5gNaOH固体时,_______向托盘上的表面皿内加NaOH固体,__________向托盘内加砝码。
用化学用语表示:
(1)磷元素(2)5个二氧化氮分子
(3)大理石的主要成分(4)天然气的主要成分
(5)+2价铁元素(6)缺少元素易得佝偻病
为测定空气中氧气所占的体积分数,某同学设计了如图实验,在一个耐热活塞的底部放一小块(足量)白磷,然后迅速将活塞下压,可以观察到的现象为;冷却至原来温度时,慢慢松开手,活塞最终将回到刻度处,试回答白磷燃烧的原因;由此实验可以得出的结论是。
某同学设计了在导管口系一个有很多小孔的气球(如图)的装置,测定空气中氧气含量。实验装置如图。该同学的实验步骤如下: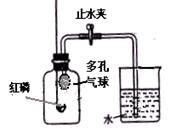
①将图中的集气瓶分成5等份,并作好标记
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷稍过量,目的是
(2)步骤③中打开止水夹后观察到的现象是
由此可以得出的有关空气组成的结论是
(3)由此你还可以得到氮气的一些性质:物理性质;化学性质
(4)若实验中进入集气瓶的水不足容积的五分之一,可能原因主要有:
①;②。
为了监测我校化学实验室的空气质量状况,小欣同学想收集一瓶实验室中的空气进行研究,请你帮他设计一个收集气体的方法。