小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好)。
| 实验编号 |
实验药品 |
分解温度(℃) |
| ① |
氯酸钾 |
580 |
| ② |
氯酸钾、二氧化锰(质量比1:1) |
350 |
| ③ |
氯酸钾、氧化铜(质量比l:1) |
370 |
| ④ |
氯酸钾、氧化铁(质量比1:1) |
390 |
【分析数据、得出结论】
(1)由实验__________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是_________________。
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后 不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证 。
(3)同种催化剂,还有 因素可能影响催化效果。
(2013吉林)2013年中央电视台举办的“3.15”晚会,曝出某品牌金饰品掺假的事件,引起同学们的好奇。某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动。
【提出问题】
(1)怎样鉴别真假黄金?
(2)怎样确定钯的金属活动性?
【查阅资料】
(1)假黄金通常是黄铜(Cu-Zn合金);
(2)钯(Pd)呈银白色,有金属光泽,可用作饰品。
【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
(1)鉴别黄金样品的真假
取黄金样品于试管中,滴加稀盐酸后,观察到黄金样品表面有气泡产生,该气体是 ,说明此样品为 (选填“真”或“假”)黄金。
(2)探究钯的金属活动性
依据生活经验,同学们猜想钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
. |
钯的活动性比银弱 |
| 把铂浸入氯化钯溶液中 |
无明显现象 |
钯的活动性比铂 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为 。
【废液处理】
(1)转化成沉淀。小组同学将所有液体倒入废液缸中,出现白色沉淀。写出产生该现象的化学方程式
(写出一个即可);
(2)通过科学合理的方法进一步回收金属钯。
(2013河北)乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液, ,有白色沉淀出现,证明猜想三成立。该反应的化学方程式为: 。
结论:白色固体是Ca(OH)2。
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 (选填图中装置序号)。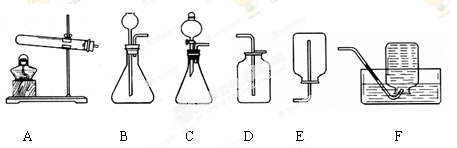
(届江苏省宜兴市第一学期期末试题)小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],碱式碳酸铜受热易分解生成CuO、H2O和CO2。据上述资料可推知,碱式碳酸铜由种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是。产生该气体的化学反应方程式为。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有、。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:①,②,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。发生反应的化学方程式为。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
(届上海市崇明县第一学期期末试题)已知草酸 (H2C2O4) 加热时在浓硫酸的催化作用下会发生分解反应,某化学兴趣小组对草酸分解的产物产生了兴趣,请你参与:
【提出猜想】甲:CO2 H2O乙: CO H2O
丙:NH3CO2 H2O丁: CO2 CO H2O
①某同学认为丙同学的猜想是错误的,理由是 (11)。
【查阅资料】氧化铁为红棕色粉末,一定温度CO能还原氧化铁;铁粉呈黑色。
【进行实验】为了验证上述猜想,将草酸在一定条件下分解的产物依次通过下列装置:
② A、B装置的顺序不能颠倒,原因是 (12)。
③实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红棕色粉末变成黑色,由此推断、(13)同学猜想成立。
④ D装置的作用是 (14),反应的化学方程式为 (15)。
【得出结论】⑤草酸分解的化学方程式为 (16)。
【反思与评价】⑥从环保角度考虑,上述实验的不足之处是 (17)。
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。
| 实验编号 |
容器I |
针筒I |
容器II |
针筒II |
红墨水液面位置 |
| a |
二氧化碳(充满) |
10mL澄清石灰水 |
二氧化碳(充满) |
10mL水 |
保持左高右低 |
| b |
0.55g锌 |
15mL盐酸 |
0.24g镁 |
15mL盐酸 |
(1)实验开始前红墨水左右两端液面保持相平。容器I、II体积相同,装置气密性良好。
(2)实验a中,容器I内产生的现象是_____________________________。红墨水液面位置发生变化的原因____________________________________________________________(用化学方程式表示)。
(3)实验b中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是________(填“I”或“II”),(4)红墨水的位置变化情况是_____________________________________。