聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
主族元素A、B、C、D、E的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体F。此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。E的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水。回答下列问题:
⑴写出元素符号A, C。
⑵E元素的最高价氧化物和盐酸反应的离子方程式为:。
⑶用电子式表示F的形成过程。
在加热的条件下B、D形成的化合物的电子式为,其中的化学键的类型为。
⑷写出一种有A、B、C、D组成的化合物的化学式。
(5)B的气态氢化物是天然气的主要成分,它的空间结构为。
(15分)如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气()
(2)浓硫酸使木条变黑()
(3)热的浓硫酸与铜片反应()
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用(选填①10mL、②50mL 、③100mL)规格的量筒;
(15分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。现按如图所示装置进行实验: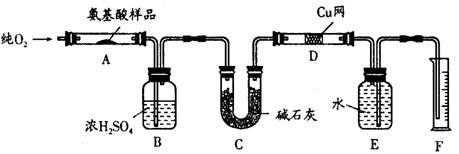
回答下列问题:
(1)E装置的作用是
(2)需加热的装置是(填字母)。
(3)氨基酸燃烧的化学方程式为
(4)D的作用是。
(5)F处读数时应注意的问题是。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题: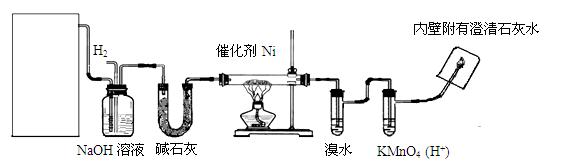
(1)方框内装置用来制取乙烯,其中包括的仪器是:①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。不选用的仪器有(填编号)。
(2)写出制乙烯化学方程式:_____________________________。
(3)碱石灰的作用是:_____________________。
(4)实验过程中,发现溴水会褪色,可能的原因是:_____________。
(5)出现什么现象可说明生成了乙烷?_______________________。
(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有__________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有__________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是____。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了如图所示的实验。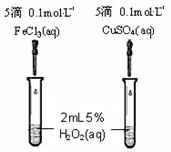
①可通过观察来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是;
若不采用A同学的改进方案,你认为还可以如何改进?。