某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
下列说法中正确的是( )
| A.30~40 min间该反应使用了催化剂 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.30 min时降低温度,40 min时升高温度 |
| D.8 min前A的平均反应速率为0.08 mol·L-1·min-1 |
对于可逆反应2AB3(g) 2A(g) + 3B2(g)ΔH>0下列图象不正确的是
2A(g) + 3B2(g)ΔH>0下列图象不正确的是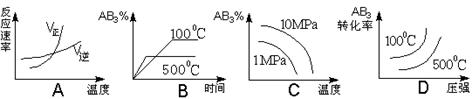
下列说法或表示方法中正确的是()
| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH=+1.9KJ/mol ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.放热及熵增加的反应,一定能自发进行 |
在某容积不变的密闭容器中放入一定量的NO2,发生反应2NO2(g)  N2O4(g);ΔH<0,在达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是 ( )
N2O4(g);ΔH<0,在达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是 ( )
| A.通入N2 | B.通入NO2 | C.通入N2O4 | D.降低温度 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2++)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2++)变小 |
| C.升高温度,平衡体系中c(Pb2++)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |