A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是: 周期 族。
(2)A与C形成的18电子分子的结构式为: 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
A.B4沸点比P4(白磷)低,属于原子晶体
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K |
303 |
313 |
323 |
| BA3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断ΔH0 (填“>”、“=”或“<”);
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)= 0.2 mol/L,此时的温度为。
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。
(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1 mol CO、2 mol H2 |
1 mol CH3OH |
2 mol CH3OH |
|
| 平衡时数据 |
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应放出或吸收的能量 |
x kJ |
y kJ |
z kJ |
|
| 反应物转化率 |
Ф1 |
Ф2 |
Ф3 |
请比较以下每组数据的大小(填“>”、“<”或“=”):
①2c1c3② x+y90.8③Ф1+Ф31
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。
(1)若A为短周期金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。请指出D物质的类别;并写出B溶液pH>7的离子方程式;
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子。
①C中所含化学键的类型是;
②写出反应II的化学方程式;
③将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为,a点溶液中各离子浓度由大到小的关系是。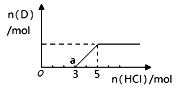
(3)若将(2)中的气体D通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP,(填:增大、减小或不变),组成不溶物F的阴离子在溶液中的浓度为mol/L。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
HmDm的电子式___________________。
C、D元素的非金属性强弱顺序为:________ _
将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
_________________________________________________________________。
常温下,将等物质的量浓度的Hm-1E溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式。在该溶液中溶质中含有的化学键类型是
在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
已知常见金属单质A有以下物质相互转化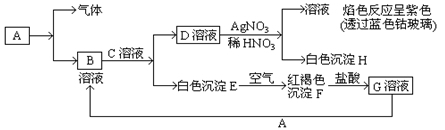
试回答:
(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出检验G溶液中的金属阳离子的试剂是(写化学式);向G溶液加入A的有关离子反应方程式。
已知:①A、B、C、D四种物质均含有元素X,有的还有可能含有元素Y、Z。且元素Y、X、Z的原子序数依次递增。②X在A、B、C、D四种物质中都不呈现其最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热分解,可制得元素Y的单质。试根据以上叙述回答:
(1)写出A、B、C、D的化学式::A_______B_______C_______D______。
(2)写出③、④中的两个化学方程式:
③,④ 。