(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 |
性质 |
化学方程式 |
| 示例 |
氧化性 |
H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 |
|
|
| 2 |
|
|
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
(7分)据报道,摩托罗拉公司开发了一种以甲醇为原料,以 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为____ _____。
(2)充电时:①原电池的负极与电源_________极相连。
②阳极的电极反应为__________________。
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗 _________L(标准状况下)。
_________L(标准状况下)。
(7分)在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是。其原因是(以离子方程式及简要文字说明)。
(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4KJ/mol" ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol" ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。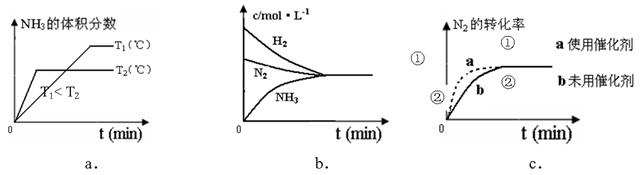
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(8分)(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为。
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是,产生该现象的原因是(用离子方程式或文字表示)。
(6分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |