将一摩尔质量为M g/mol的物质Wg,完全溶解制成VmL饱和溶液,若此溶液的密度为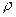 g/mL,则该物质在此温度下的溶解度是___________g,溶质的质量分数是_____________
g/mL,则该物质在此温度下的溶解度是___________g,溶质的质量分数是_____________
现有①Ar②金刚石③NH4Cl④SiO2⑤干冰⑥K2S六种物质,按下列要求回答:(填序号)
(1)只存在共价键的是__ ___,既存在离子键又存在共价键的是。
(2)熔化时不需要破坏化学键的是_______,熔化时需要破坏共价键的是。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
试回答下列问题
(1)由实验②可知溶液中含有的离子为,在100mL溶液中该离子的物质的量浓度为
(2)由实验③可以判断中溶液中含有的离子为
(3)由上述实验信息判断下列说法中正确的是
| A.K+一定存在 | B.100mL溶液中含0.01mol CO32- |
| C.Cl-可能存在 | D.Ba2+一定不存在,Mg2+可能存在 |
填写下列表格
| 物质 |
分子数 |
质量/g |
物质的量/mol |
摩尔质量/g.mol-1 |
| H2O |
3.2×1023 |
|||
| N2 |
9 |
|||
| HNO3 |
0.5 |
完成下列化学反应
(1)电解饱和食盐水
(2)二氧化锰与浓盐酸反应制氯气
(3)以氯气和石灰乳为原料制造漂白粉
(4)向漂白粉溶液中通入二氧化碳气体
纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应方程式为:
4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
⑴电化学法制备Cu2O时,铜棒做极,阴极生成Cu2O的电极反应式为。
⑵湿化学法中,检验纳米Cu2O已经生成的实验方法是。
⑶湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,计算产品中Cu2O的质量分数。(写出计算过程)