完全中和9.8g三元含氧酸酸H3AO4,消耗氢氧化钠12g,此三元酸物质的量是__ ______,相对分子质量是_____ __.已知该酸是弱酸,请用其实际化学式分三步写出电离方程式 。
如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。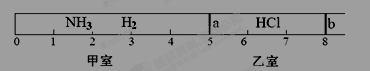
(1)甲室中气体的物质的量为 。
(2)甲室中气体的质量为 。
(3)甲室中NH3,H2的物质的量之比为 。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“ ”处(填数字)。
某一反应体系中涉及的反应物和生成物共有4种物质:X、Cl2、NH3、N2。当转移的电子总数为a个时,氮气数量变化了bmol。
(1)阿伏伽德罗常数为 (用含啊a、b的代数式表示)
(2)X可能有两种组成:HCl、NH4Cl,为确定X的化学式,某同学分别取同温同压下体积分别为V1、V2的两种物质(氧化剂与还原剂)充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温后,再测出容器的容积V3。
①若实验结果是________ (用V1、V2与V3间关系来表示,后同) ,则X的化学式一定为HCl。
②若实验结果是_________,则X的化学式为NH4Cl
(共10分)A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A是宇宙中含量最高的元素,B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)写出元素C在元素周期表的位置 ,单质E的工业制备的离子方程式为________。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),
B的单质在加热条件下能与C的最高价氧化物对应的水化物的浓溶液反应,写出对应的化学方程式 。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间反应的一个离子方程式: 。
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题
(1)NO的危害在于
a.破坏臭氧层b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合d.当它转化为N2后使空气中O2含量降低
(2)在含有Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和NO2-在酸性溶液中转化为NO的离子方程式 _________ 。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为 。
(4)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) _________。
(5)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是__________________。
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)_____ ___ __
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式
(3)将A、B溶液中各溶质的物质的量浓度填入下表
| 溶质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
| C(mol/L) |