由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),试回答以下问题:
(1) 上述反应中属于取代反应有 。
(2) 化合物的结构简式:B ,C ;
(3) 反应④所用试剂和条件是 ;
(4) 写出反应②、⑤的化学方程式:反应② ;
反应⑤ 。
如图是s能级和p能级的原子轨道图,试回答下列问题: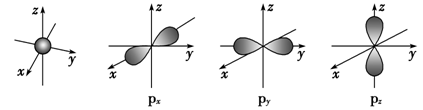
(1)s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是_______,它的氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为________,原子的电子排布图为___________。
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为、;
(2)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是_________________;
(3)Q的元素符号是_____,它属于第_____周期,它的核外电子排布式为_____,在形成化合物时它的最高化合价为_____;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键_________________。
(5)YZ2在固态时为_____晶体,1 mol YZ2中含σ键_____mol,π键_____mol。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图: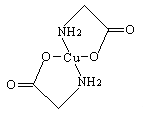
(1)Cu元素基态原子的外围电子排布式为。
(2)元素C、N、O的第一电离能由大到小排列顺序为。
(3)A中碳原子的轨道杂化类型为。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是。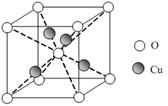
当n=4时(n为主量子数,n值所表示的电子运动状态称为电子层),电子层的最大容量为________个电子,如果没有能级交错,该层各轨道的能量由高到低的顺序为________。
(1)有一种金属结构单元是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子),该单元平均是由个金属原子组成的。
(2)如果有一种立方晶胞中每个顶点、面心、边心、体心都各有一个金属原子,则此晶胞有个金属原子。