当n=4时(n为主量子数,n值所表示的电子运动状态称为电子层),电子层的最大容量为________个电子,如果没有能级交错,该层各轨道的能量由高到低的顺序为________。
有关FeSO4的转化关系如下图所示(无关物质已略去)。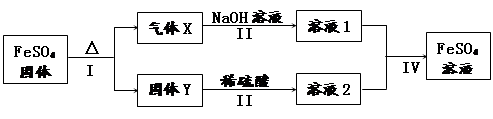
已知:① X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
② Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是 。
(3)向FeSO4溶液中加入某一物质可变成溶液2且不引入任何杂质,写出该过程的离子方程式
(4)溶液2中金属阳离子的检验方法是 。
(Ⅰ)某盐有原子序数处于前20的三种元素组成,相对分子质量为98,其焰色反应为紫色(透过蓝色的钴玻璃)。向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀。
(1)三种元素中原子序数最小的简单离子的离子结构示意图 ,
(2)该盐的化学式为 ,
(3)该盐溶液滴入少量盐酸的离子方程式 。
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C。在一定条件下可以用H3PO2与CuSO4溶液混合制备A,经鉴定反应后的溶液是磷酸和硫酸的混合物。且A能在氯气中燃烧。
(1)A的化学式为 ,
(2)写出用H3PO2与CuSO4溶液混合制备A的反应方程式 ;
(3)写出A在氯气中燃烧的方程式 ;
(4)有人认为还有一种组成元素与A相同的二元化合物, 若此物质为离子化合物,则电子式为 ;
(5)A与盐酸能反应的原因 。
Ⅰ(1)CO可用于炼铁,已知Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g)ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
Ⅱ(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:负极的电极反应式是 。
(3)下图是一个电化学过程示意图。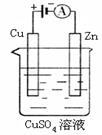
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(1)某有机物含碳85.7%、氢14.3%,向80 g含溴5%的溴水中通入该有机物,溴水恰好完全褪色,此时液体总重81.4 g。
①该有机物的分子式: __ ____;
②经测定该有机物分子中有两个—CH3,写出它的结构简式:_________________,______________。
(2)某烃的相对分子质量为92 ,该烃不能使溴的四氯化碳溶液褪色,能使酸性高锰酸钾褪色。回答下列问题:
①写出该烃与硝酸反应的化学方程式: ;
②该烃与氢气加成反应产物的1H核磁共振谱图中有 种不同化学位移的氢原子。
完成下列各小题。
(1)系统命名: ;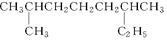
(2)写出支链只有一个乙基且式量最小的烷烃的结构简式: ;
(3)篮烷的结构如图所示: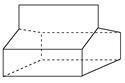
①蓝烷的分子式为________________________;
②蓝烷不具有的性质___ _____;
a.不能溶于水 b.密度大于水
c.能与溴水发生加成反应d.常温、常压下为气体
③蓝烷的一氯代物有________种。