已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
下图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
| A.Janusene的分子式为C30H20 |
| B.Janusene属于苯的同系物 |
| C.Janusene苯环上的一氯代物有8种 |
| D.Janusene既可发生氧化反应,又可发生还原反应 |
将一定质量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20 g,滤液质量比原石灰水减少5.8 g,该有机物可能是
| A.乙烯 | B.乙二醇 | C.乙酸 | D.甲酸甲酯 |
某有机物ng,跟足量金属钠反应生成vLH2,另取ng该有机物与足量碳酸氢钠作用生成vLCO2(同一状况),该有机物分子中含有的官能团为
| A.含一个羧基和一个羟基 | B.含两个羧基 |
| C.只含一个羧基 | D.含两个羟基 |
白藜芦醇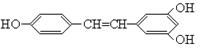 广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是
| A.1mol 1 mol | B.3.5 mol 7 mol |
| C.3.5 mol 6 mol | D.6 mol 7 mol |
胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法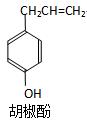
①该化合物属于芳 香烃
香烃
②分子中至少有7个碳原子处于同一平面
③它的部分同分异构体能发生银镜反应
④1mol该化合物最多可与2molBr2发生反应。其中正确的是
A.①③  |
B.①②④ | C.②③ | D.②③④ |