根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 回答下列问题:
(1)氧化剂是 ,氧化产物是 。
(2)氧化剂与氧化产物的物质的量比是 。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,反应中转移的电子数为 ;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
现有以下物质 ①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦酒精⑧稀H2SO4溶液 ⑨KOH固体 (填序号)
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中,属于非电解质的是
已知下列反应:
①N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
② 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g);ΔH<0
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是__________________________________;
(2)为有效提高氢气的转化率,理论上可采取的措施有__________;
| A.降低温度 | B.最适合催化剂活性的适当高温 | C.增大压强 | D.降低压强 |
E.循环利用和不断补充氮气 F.及时移出氨
(3)反应②的化学平衡常数表达式K=________________________,
温度降低时,K值______________(填“增大”、“减小”或“无影响” );
);
(4)在0.5L的密闭容器中,加入2.5mol N2和 7.5mol H2,当该反应达到平衡时,测出平衡混合气的总物质的量为6 mol,则平衡时氮气的转化率=
( 8 分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)、该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)、减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)、若加入B(容器体积不变),则A的转化率_________,B的转化率_________。
(4)、若升高温度,则平衡时B、C的浓度之比: c(B)/ c(C)将_________。
(5)、若B是有色物质,A、C均无色,则加入C(容器体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填 “变深”“变浅”或“不变”)。
“变深”“变浅”或“不变”)。
( 8 分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,c、d为两个铂片,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: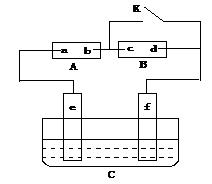
(1)电源A上的a为_____极
(2)滤纸B上发生的总化学方程式为:_______________________________
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e上发生的反应为:____________ ____ ,C中盛放的电镀液可以是______溶液。
( 8 分)采用惰性电极从NO3-、SO42-、Cl-、Cu2+、Na+、Ag+、H+ 选出适当离子组成的电解质(非熔融态下),并电解其水溶液
(1)若两极分别放出H2和O2,电解质可能为。
(2)若阴极析出金属,阳极放出O2,电解质可能为。
(3)若两极分别放出气体,且体积比为 ,电解质可能为。
,电解质可能为。
(4)若既无O2也无 H2放出,则电解质可能为。
H2放出,则电解质可能为。