有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是 ,一定不含有的物质是 ,(均填化学式)。对可能含有的物质,可采用向滤液中滴加 溶液的方法来检验。
(2)写出步骤③中的离子方程式 。
现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)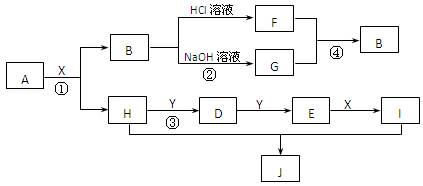
根据上述转化关系图回答:
(1)写出下列物质的化学式 X;J
(2)物质H的电子式:;
物质J属于哪种晶体类型: 。
。
(3)写出反应①的化学方程式;
写出反应④的离子方程式。
(共13分)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物完全燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的碳碳三键,核磁共振氢谱有三个峰,峰面积为6﹕1﹕1。
(1)A的分子式是;(2)A的结构简式是;
(3)下列物质中,一定条件能与A发生反应的是(填字母);
A.H2 B.Na C.KMnO4 D.Br2
(4)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。则B的结构简式是。
(共15分)写出下列有机反应的化学方程式
(1)实验室制取乙炔:;
(2)2-溴丙烷与NaOH的醇溶液的反应:;
(3)向苯酚钠溶液中通入少量的CO2;;
(4)由甲苯制取TNT;;
(5)苯甲醇的催化氧化;。
(共12分)根据给出的有机物的结构简式或名称按要求填空:
①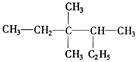 ②
②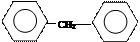 ③
③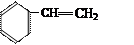
④5,5-二甲基-4-乙基-2-己炔⑤ ⑥
⑥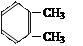
⑦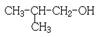

(1)写出①的系统命名法的名称;(2)写出④的结构简式;
(3)属于脂肪烃的是(填序号);(4)属于芳香烃的是(填序号);
(5)属于苯的同系物是(填序号);(6)任写一种与⑧ 互为同分异构体的结构简式。
互为同分异构体的结构简式。
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式。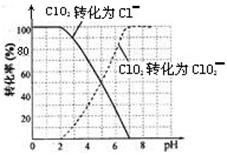
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为mol·L-1(用含字母的代数式表示)。
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差 ,工业上用湿法制备高铁酸钾的基本流程如下图所示:
,工业上用湿法制备高铁酸钾的基本流程如下图所示:
⑴在农业生产中,滤液1可用作。
⑵流程中生成高铁酸钾的离子方程式是:,控制此反应温度30℃以下的原因是: 。
。
⑶结晶过程中加入浓KOH溶液的作用是:。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在附近、反应时间应控制在。