(1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
①T1 T2 ,正反应的△H 0。(填“>”、“<”或“=”,下同)。
②P1 P2 , L为 。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量 92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是 (填字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为 mol、 。
某气态烷烃和乙烯等体积混合时,1体积混合气体完全燃烧消耗同温同压下4.75体积氧气。试回答:
(1)该烷烃的分子式为;
(2)该烷烃所有同分异构体的结构简式为。
糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为Ca(H2O)6,则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇【结构简式为:CH2 OH(CHOH)3CH2OH】是一种甜味剂,糖尿病人食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有种同分异构体。
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60。
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3。
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入溶液,发现有气泡冒出;
写出A与酒精反应的化学方程式。
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质。下列说法正确的是。
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂
A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为:
_____________________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:
_____________________________________________________________
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为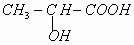 。
。
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示
回答下列问题:(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是,产生的现象为
(4)写出下列反应的反应类型:①,④。
(5)写出下列反应的化学方程式:
①;
②;
③F与金属钠反应的化学方程式为
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)元素的原子间反应最容易形成离子键的是下列中的(),元素的原子间反应容易形成共价键的是下列中的()
A.c和f B.b和g C.d和g D.d和e
|
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是
A.ea3 B.ag C.fg3 D.dg4