天然有机产物A是芳香族化合物,其中碳的质量分数是氧质量分数的2倍,完全燃烧后仅得到物质的量之比为2︰1的CO2和H2O。A具有极弱的酸性,且能与HI作用得到B,结构分子显示A分子内无相同官能团而B分子内对位有相同官能团,A分子内无氢键而B分子内有氢键。
已知 R–O–R′ +HI→R–O–H + R′–I
(1 ) A的化学式为
(2) 写出A、B的结构简式(B中标出氢键) ,
(3) 与A具有相同官能团的位置异构体有 种(含自身)
与B具有相同官能团的位置异构体有 种(含自身)
(4) A另有一种异构体C,无酸性,但能与NaOH以1︰3反应。
写出C与NaOH反应的化学方程式 。
(4分)核磁共振谱是测定有机物分子结构最有用的工具之一。瑞士科学家维特里希等三人即是利用核磁共振技术测定生物大分子的三维结构而获得2002年诺贝尔化学奖。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为 ,其PMR谱中有2个信号峰,其强度之比为3∶1。
,其PMR谱中有2个信号峰,其强度之比为3∶1。
(1)下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是________。
| A.CH3—CH3 | B.CH3CHO |
| C.CH3CH2OCH2CH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的PMR谱上只有1个峰,则A的结构简式为___________。B的PMR谱上有__________________个峰,强度比为________________。
(6分)用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下: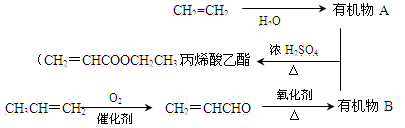
根据以上材料和你所学的化学知识回答下列问题:
(1)丙烯醛(CH2=CHCHO)中含有的官能团____________________(填名称)。
(2)A与B合成丙烯酸乙酯的化学方程式是__________。
(3)由石油裂解产物丙烯合成聚丙烯塑料的化学方程式是:。
(12分)(1)按系统命名法命名.
①有机物CH3CH(C2H5)CH(CH3)2的名称是________________________.
②在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如: 。C7H16的同分异构体中具有“手性碳原子”的有_____种,写出其中一种的名称 _____ 。
。C7H16的同分异构体中具有“手性碳原子”的有_____种,写出其中一种的名称 _____ 。
(2)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷 _____________________________________
②支链只有一个乙基且式量最小的烷烃_______________________________
③3-乙基-4-甲基-2-戊烯___________________________________________
(3)腈纶(人造羊毛)的主要成份是聚丙烯腈(丙烯腈:CH2=CH—CN),由乙炔和氢氰酸(HCN)生产聚丙烯腈所涉及的有机化学反应方程式为________________、______________,
反应所属类型分别为__________、_________。
某物质的分子式为C4H10O。
(1)它能被催化氧化生成相同碳原子数的醛有_________种,
它们对应的醇分别为(写结构简式)___________,___________。
(2)它能被催化氧化成相同碳原子数的酮有种,写出结构简式并命名_________,___________。
(3)不能被催化氧化的醇的结构简式和名称___________,___________。
(4)能发生消去反应,有机产物只有一种物质的有_________种;两种的有_________种,产物的结构简式为_________和_________。
(探究题)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1)正四面体烷的分子式为________________,其二氯取代产物有______________种。
(2)关于乙烯基乙炔分子的说法错误的是____。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:__________________。