[化学-选修化学与技术]
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: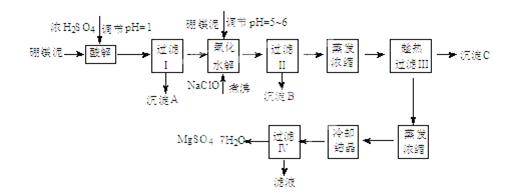
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)铁元素位于元素周期表的 区;其基态原子的电子排布式为 。
(2)铜原子的价电子排布式为,画出配离子[Cu(H2O)4]2+中的配位键___________。
(3)二氧化碳分子的立体构形为形,其中C原子的杂化方式为杂化,二氧化碳分子中含有个σ键和个π键。
(4)氨分子属于分子(填“极性”或“非极性”);氨极易溶于水最主要的原因是氨分子和水分子之间可以形成。
(5)下列元素的第一电离能最大的是()
A.Be B.CC. N D.O
(6)下列分子中,所有原子都满足最外层为8电子结构的是()
A.XeF2 B.BeCl2C.PCl3 D.CHCl3
(7)下列晶体中,熔点最高的是 。
A.金刚石 B.干冰 C.铝 D.氯化钠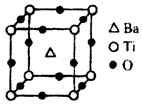
(8)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如上图,它的化学式是 。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g)ΔH =" —148.9" kJ/mol
SiF4(g)+ 2H2O(g)ΔH =" —148.9" kJ/mol
根据题意完成下列填空:
(1)在地壳深处容易有气体逸出,在地壳浅处容易有沉积。
(2)如果上述反应的平衡常数K值变大,该反应(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为。
(14分)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g) 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:
(1)达到平衡所需要的时间:t(A)t(B),NH3的转化率:a(A)a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A)v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向反应方向移动,A中的化学反应速率(填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量,B容器中NH3的百分含量(填“增大”、“减小”或“不变”)。
(12分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) H2(g) + CO(g),ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
H2(g) + CO(g),ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
该反应在低温下能否自发进行(填:“能”或“否”)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K=(填数值)。
N2 (g)+ 3H2(g)的K=(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正v(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是(填字母)。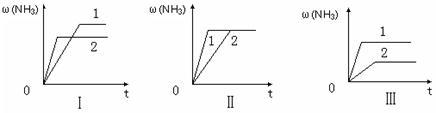
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能,1>2 |
Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g);ΔH=E1①
C(s)+H2O(g)=CO(g)+H2(g)ΔH=E2②
H2(g)+1/2O2(g)=H2O(g);ΔH=E3③
CO(g)+1/2O2(g)=CO2(g);ΔH=E4④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即。
(2)上述四个热化学方程式中ΔH>0的反应有。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。