某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是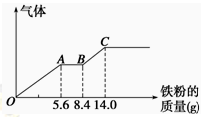
| A.原混合酸中NO3-物质的量为0.1 mol |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
一些中草药中常存在下列四种香豆素类化合物,有关说法正确的是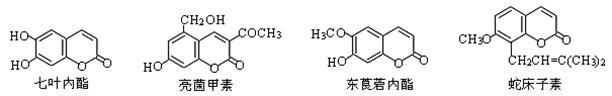
A.七叶内酯与东莨菪内酯 互为同系物 互为同系物 |
| B.四种化合物含有的官能团种类完全相同 |
| C.它们都能使溴的四氯化碳溶液褪色 |
| D.1mol上述四种物质与足量氢氧化钠溶液反应,消耗氢氧化钠最多的是亮菌甲素 |
用乙烯在硫酸催化下的水化法合成乙醇,事实上经过下列步骤:首先在较低温度下用浓硫酸吸收乙烯: CH2=CH2 +H2SO4(浓) → CH3CH2OSO3H (Ⅰ),然后生成物(Ⅰ)再进一步吸收乙烯:CH3CH2OSO3H + CH2=CH2→(CH3CH2O)2SO2(Ⅱ),再加入水,(Ⅰ)和(Ⅱ)都与水反应生成乙醇:CH3CH2OSO3H +H2O → CH3CH2OH + H2SO4;(CH3CH2O)2SO2 +2H2O → 2CH3CH2OH + H2SO4
→ CH3CH2OSO3H (Ⅰ),然后生成物(Ⅰ)再进一步吸收乙烯:CH3CH2OSO3H + CH2=CH2→(CH3CH2O)2SO2(Ⅱ),再加入水,(Ⅰ)和(Ⅱ)都与水反应生成乙醇:CH3CH2OSO3H +H2O → CH3CH2OH + H2SO4;(CH3CH2O)2SO2 +2H2O → 2CH3CH2OH + H2SO4
下列叙述中正确的是
①化合物(Ⅰ)、(Ⅱ)都属于酯类 ②生成(Ⅰ)、(Ⅱ)的反应都属于加成反应
③生成醇的反应都属于取代反应
| A.①②③ | B.只有②③ | C.只有① | D.只有①③ |
邻甲基苯甲酸(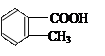 )有多种同分异构体,其中属于酯类,且分子结构
)有多种同分异构体,其中属于酯类,且分子结构
中有甲基和苯环的异构体有
| A.2种 | B.3种 | C.4种 | D.5种 |
右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此下列说法正确的是()
| A.该硫酸试剂可以做干燥剂,干燥任何气体 |
| B.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C.常温下,2.7gAl与足量的稀硫酸反应得到H2 3.36L |
| D.配制200mL 4.6mol·L-1的稀硫酸需取该硫酸50.0mL |
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是()
| A.Al3+ | B.Cl- | C.Mg2+ | D.Ba2+ |