有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
A的单质是密度最小的物质 |
| B |
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C |
C的原子最外层电子数是其内层电子数的三倍 |
| D |
D与B同周期,该周期中D的简单离子半径最小 |
| E |
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F |
F元素最高正价与最低负价的代数和为4 |
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。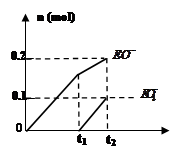
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,
⑴、该溶液中肯定含有的离子是,且各离子的物质的量之比为;肯定不含的离子是。
⑵、还有一种离子可能存在,写出检验这种离子的实验方法及现象:
。
(1)油脂被摄入人体后,在酶的作用下水解为和甘油(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“糖类”)不足引起的。下列食物中富含该物质的是(填字母)。
| A.菠菜 | B.花生油 | C.瘦肉 | D.西瓜 |
(3)某品牌抗酸药的成分主要有糖衣、碳酸钙、淀粉等。
①写出该抗酸药发挥功效时的离子方程式:。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,写出其水解方程式:。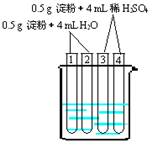
(4)上图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
| 编号 |
操作 |
现象 |
| 1 |
加入碘水 |
溶液变成蓝色 |
| 2 |
加入银氨溶液,水浴加热 |
未出现银镜 |
| 3 |
加入碘水 |
溶液变成蓝色 |
| 4 |
加入银氨溶液,水浴加热 |
未出现银镜 |
①结合试管1、2中的现象,得出的结论是,这两支试管中淀粉水解(填“没有”、“部分”或“全部”)。
②结合试管3、4中的现象,不能得出“这两支试管中淀粉没有水解”的结论,理由是
。
防治环境污染,改善生态环境己成为全球的共识。
(1)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有(填字母)标志的垃圾筒内。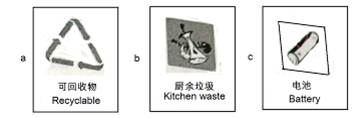
(2)工业废水需处理达标后才能排放。下列废水处理的方法合理的是(填字母)。
a.用中和法除去废水中的酸
b.用混凝法除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
d.用氧化还原法除油类、氰化物
(3)为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石。石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程式:。
某芳香烃A有如下转化关系: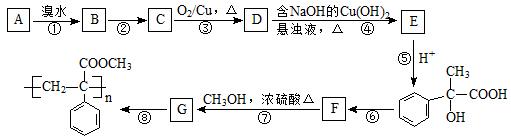
按要求填空:
⑴写出反应②和⑥的反应条件:②;⑥。
⑵写出A和G结构简式:A;G。
⑶写出反应③对应的化学方程式:;
⑷写出反应⑦对应的化学方程式:。
⑸属于取代反应的有(填序号),反应⑧的反应类型属于。
通过下列实验比较① ② CH3CH2OH ③ H-OH④
② CH3CH2OH ③ H-OH④
⑤ 五种物质中羟基上氢原子的活泼性顺序。在下表中填写实验现象及实验结论。
五种物质中羟基上氢原子的活泼性顺序。在下表中填写实验现象及实验结论。
| 编号 |
实验操作 |
实验现象 |
实验结论 |
| 1 |
分别取上述五种物质的少量溶液或液体于试管中,各滴入几滴石蕊试液 |
||
| 2 |
分别取适量①、⑤的水溶液,各加入少量NaHCO3固体 |
||
| 3 |
分别取少量②、③、④,各加入适量NaOH溶液,再通入足量CO2 |
||
| 4 |
分别取少量②、③的液体,各加入一小粒金属钠 |
结论:上述五种物质中的羟基上氢原子活泼性顺序为(填序号)