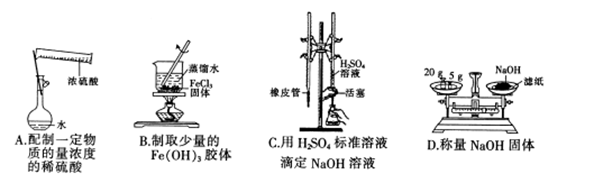
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
| A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B.SO2能使溴水溶液褪色,是由于SO2具有漂白性 |
| C.为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用 |
| D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |
下列有关热化学方程式的叙述正确的是
| A.在稀溶液中:H+(aq)+OH-(aq) ="=" H2O(l) ΔH=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| B.已知C(石墨,s)==C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.需要加热的反应说明它是吸热反应 |
| D.已知2C(s)+2O2(g)==2CO2(g) ΔH1;2C(s)+O2(g)=="2CO(g)" ΔH2,则ΔH1>ΔH2 |
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2→ 2CH3CHO。下列有关说法正确的是
| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
下列图示与对应的叙述相符的是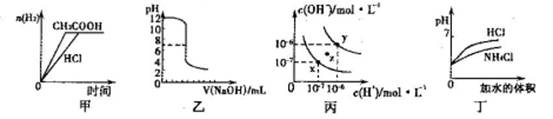
| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点到x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |
下列实验装置或操作设计正确且能达到实验目的的是