下列离子方程式书写正确的是
| A.在Fe(OH)3胶体中加入HI溶液:Fe(OH)3 +3H+=Fe3+ +3H2O |
| B.在稀氨水中通入少量SO2:NH3•H2O+SO2=NH4++HSO3- |
| C.向澄清石灰水中加入足量NaHCO3溶液: Ca2+ +OH-+HCO3-=CaCO3↓+ H2O |
| D.在酸性KMnO4溶液中加入H2O2: 2MnO4-+5H2O2 +6H+=2Mn2++5O2↑+ 8H2O |
某工厂废水中含 的
的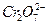 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 的流程图:
的流程图: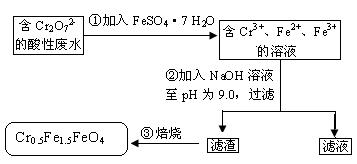
下列有关判断错误的是
| A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3 |
| C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价的铁的质量之比为2:3 |
| D.若废水中杂质不与绿矾反应,将该l L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g |
在一定条件下的密闭容器中投入4 molA和n mol的B,发生如下反应4A+5B 4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是
4C+6D。达到平衡时,测得A的转化率大于B的转化率。则n的取值范围正确的是
A.n="5" B.n<5 C.n>5 D.无法判断
已知亚硫酰氯(SOCl2)溶于水产生大量白雾和刺激性气味气体.有一种锂电池,用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列有关叙述中,正确的是
| A.锂为电池的正极,石墨作电池的负极 |
| B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| C.电解质溶液中混入水,对电池反应无影响 |
| D.电池工作过程中,锂提供的电子与正极区析出硫的物质的量之比为4:1 |
常温下,向含2 mol NaClO的稀溶液中通入1 mol CO2二氧化碳,充分反应后,生成1 mol HClO和1 mol NaHCO3,
经检验溶液 .有关反应后该混合溶液的叙述正确的是
.有关反应后该混合溶液的叙述正确的是
| A.上述反应对应的离子方程式为2ClO-+CO2+H2O=2HClO+CO32- |
| B.上述溶液中:c(ClO-)>c(HCO3-)>c(CO32-) |
| C.上述溶液中:c(ClO-)+c(HClO)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.上述溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-) |
瑞典皇家科学院2009年6日宣布,华人科学家高锟以及两名美国科学家Willard Boyle和George Smith获得2009
年诺贝尔物理学奖,以奖励他们在光纤和半导体领域上的开创性研究。下列有关光导纤维和半导体的有关说法错误的是
| A.二氧化硅是制备光导纤维的原料,光导纤维遇碱会“短路” |
| B.作半导体材料的硅位于周期表中金属与非金属分界线附近 |
| C.工业上,利用二氧化硅热分解法冶炼硅 |
| D.二氧化硅和硅属于同种晶体类型 |