已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
由此可知,在等温下蒸发36 g液态水需吸收的热量( )
| A.483.6 kJ | B.88 kJ | C.285.8 kJ | D.44 kJ |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8KJ/mol |
| B.已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定 |
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+ H2SO4(ag)= H2SO4(ag)=  Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol |
D.己知C(s)+ O2(g)= CO2(g);△H1C(s)+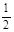 O2(g)= CO(g);△H2则△H1>△H2 O2(g)= CO(g);△H2则△H1>△H2 |
下列实验操作或对实验事实的叙述中存在错误的是
| A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 |
| B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| C.酸碱中和滴定时,锥形瓶未用待装液润洗。 |
| D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。 |
下列事实中,不能用勒沙特列原理来解释的是
| A.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体 |
B.对于反应H2(g)+I2(g) 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
下列说法中,正确的是
| A.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)<Ksp(AgI) |
| B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
| C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
| D.强电解质的水溶液中不存在分子 |
奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:6CO(NH2)2 6NH3+3CO2+C3H6N6,对C3H6N6说法正确的是
6NH3+3CO2+C3H6N6,对C3H6N6说法正确的是
| A.摩尔质量为126 |
| B.式量为126g·mol-1 |
| C.每个C3H6N6分子含3个N2分子 |
| D.0.1molC3H6N6含碳原子数为1.806×1023 |