下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8KJ/mol |
| B.已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定 |
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+ H2SO4(ag)= H2SO4(ag)=  Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol |
D.己知C(s)+ O2(g)= CO2(g);△H1C(s)+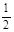 O2(g)= CO(g);△H2则△H1>△H2 O2(g)= CO(g);△H2则△H1>△H2 |
FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中存在的金属离子是
| A.Fe2+ | B.Fe3+和Fe2+ | C.Cu2+和Fe2+ | D.Cu2+ |
物质的量相同的任何气体物质,一定相同的是
| A.体积 | B.质量 | C.原子数 | D.分子数 |
自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等。试想,如果把某元素由化合态变为游离态,则该元素
| A.被氧化 | B.有可能被氧化,也有可能被还原 |
| C.被还原 | D.该元素既不被氧化也不被还原 |
下列化学方程式中,不能用H+ + OH- = H2O表示的是
| A.2NaOH + H2SO4 = Na2SO4 + 2H2O |
| B.Ba(OH)2 + 2HCl = BaCl2 + 2H2O |
| C.Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O |
| D.KOH + HCl = KCl + H2O |
下列实验现象的描述错误的是
| A.新制氯水使淀粉试纸呈蓝色 |
| B.向NaHCO3固体加入新制氯水,有无色气体产生 |
| C.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,呈血红色 |
| D.在新制氯水中滴加AgNO3溶液有白色沉淀生成 |