在 K2Cr2O7 +14HCl="2KCl" + 2CrCl3 + 3Cl2+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用(未被氧化)的HCl的质量比为 。
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。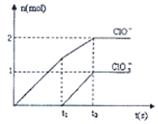
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:。
(3)该石灰乳中含有Ca(OH)2的物质的量是mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3—六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含的离子是_______________________。
(2)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是___ _______(填化学式)。
(3)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为________。
在烧杯里加入20 mL 0.1 moI/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液并实验溶液的导电性。实验装置如下图(夹持仪器已去掉)。
实验现象如下:
①灯泡逐渐变暗;②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是。
(2)红色变浅说明。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为mL,离子反应方程式为
。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为____。
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是________。
(2)步骤②反应的离子方程式是________。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离
子方程式为________。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。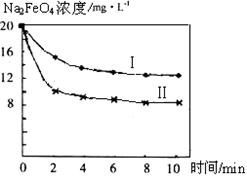
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____(答出两点即可)。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A;B;C;D;E。
(2)请用离子方程式表示A溶液显碱性的原因。
(3)写出③、④的离子方程式:③;④。