在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
下列共有十四种化学符号: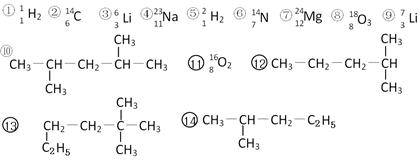
其中:
(1)表示核素的符号共有种;
(2)互为同位素的是(填序号,以下相同);
(3)中子数相等,但质子数不相等的是;
(4)有机物中是同一种物质的是;
(5)⑩的一氯代物的同分异构体数目:;⒀的一氯代物的同分异构体数目:。
有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
只含有极性键的是__________;只含有非极性键的是__________;既有极性键,又有非极性键的是______________;只有σ键的是____________;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是__________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是____________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________。
1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期 元素组成的共价分子中,互为等电子体的是:
元素组成的共价分子中,互为等电子体的是:
和;和。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体 ,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2—互为等电子体的分子有:、。
,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2—互为等电子体的分子有:、。
用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
| 分子或离子 |
PbCl2 |
XeF4 |
SnCl62- |
PF3Cl2 |
Hg Cl42- Cl42- |
ClO4-- |
| 空间 构型 |
如图,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 ml盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是______________________________________________。
(2)产生上述现象的原因是_____
(3)写出有关反应的离子方程式:____________________。
(4)由实验推知,MgCl2溶液和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。