下列实验操作、现象和解释都正确的是
| 选项 |
实验操作 |
现象 |
解释 |
| A. |
向某溶液中加入盐酸 |
产生无色气体 |
溶液中一定含有CO32− |
| B. |
新制Fe(OH)2露置于空气中一段时间 |
白色固体迅速变为灰绿色,最终变为红褐色 |
说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. |
在CuSO4溶液中加入KI溶液,再加入苯,振荡 |
有白色沉淀生产,苯层呈紫色 |
白色沉淀可能为CuI |
| D. |
向某无色溶液中滴加硝酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有SO42- |
能说明醋酸是弱电解质的是
①往苯酚钠溶液中加入醋酸可得苯酚
②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH小于5
| A.①③④ | B.①② | C.②④ | D.② |
下列条件下,两瓶气体所含原子数一定相等的是
| A.同质量的C2H4和CO |
| B.同体积、同密度的C2H4和C3H6 |
| C.同温度、同体积的H2和N2 |
| D.同压强、同体积的N2O和CO2 |
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是
| A.FeCl3 | B.Ca( HCO3)2 HCO3)2 |
C.NaAlO2 | D.Na2SO3 |
下列离子方程式书写正确的是
| A.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+ 5I-+3H2O=3I2+6OH- 5I-+3H2O=3I2+6OH- |
C.NH4HSO3溶液 与足量的NaOH溶液混合加热: 与足量的NaOH溶液混合加热:NH4++HSO3-+2OH- 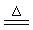 NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| D.AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ |
已知在热的碱性溶液中,NaClO发 生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
| A.NaCl、NaClO | B.NaCl、NaClO3 |
| C.NaClO、NaClO3 | D.NaClO3 、NaClO4 |