设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA |
| B.常温常压下,44 g由N2O与CO2组成的混合气体含有的氧原子数目为NA |
C.反应NH4N3 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA |
| D.1 L 1 mol·L-1的AlCl3溶液中含有Cl-的数目为3NA |
实验室有一瓶白色粉末,经元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比为39:16,(已知BaSO3是不溶于水的白色物质,可与酸反应,K2S易溶于水),下列结论不正确的是:
| A.根据元素分析的结果推测该粉末有可能是纯净物 |
| B.将粉末溶于水,加入BaCl2溶液,观察有白色的沉淀生成,证明原来的粉末是K2SO4 |
| C.将粉末溶于水,加入BaCl2溶液和盐酸,观察到有白色沉淀和气泡产生,则原粉末可能是K2SO4和K2SO3的混合物 |
| D.该粉末不可能是K2S、K2SO4和K2SO3的混合物 |
下表中评价合理的是:
| 选项 |
化学反应及其离子 方程式 方程式 |
评价 |
| A |
NaHSO4溶液与Ba(OH)2溶液反应至中性: 2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O |
正确 |
| B |
向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
| C |
向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ |
正确 |
| D |
NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- |
正确 |
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是:
A .+4 B.+5 C.+6 D.+7
.+4 B.+5 C.+6 D.+7
在以下涉及MnO2的反应中,其中MnO2做氧化剂的是:
A.2KMnO4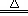 K2MnO4+MnO2+O2 ↑ K2MnO4+MnO2+O2 ↑ |
B.MnO2+4HCl(浓)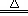 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
C.2KClO3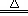 2KCl+3O2 ↑ 2KCl+3O2 ↑ |
| D.2H2O2=" 2" H2O+O2↑ |
已知98%的浓硫酸的浓度为18.4mol.L-1, 则49%的硫酸溶液的浓度为(硫酸溶液的浓度越大时,其溶液的密度越大):
| A.9.2 mol.L-1 | B.大于 9.2 mol.L-1 | C.小于 9.2 mol.L-1 | D.无法确定 |