瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,有关说法正确的是
| A.电池总反应为:4NH3+3O2=2N2+6H2O |
| B.电池工作时,OH-向正极移动 |
| C.电极2发生的电极反应为:O2+4H++4e-=2H2O |
| D.电流由电极1经外电路流向电极2 |
下列表格中各项都正确的一组是()
| 碱 |
盐 |
电解质 |
非电解质 |
|
| A |
烧碱 |
小苏打 |
BaSO4 |
干冰 |
| B |
纯碱 |
CaCO3 |
NH3·H2O |
Fe |
| C |
明矾 |
食盐 |
石墨 |
醋酸 |
| D |
KOH |
CuSO4 |
Na2SO4 |
NaClO |
下列做法会对人体健康造成较大危害的是()
| A.用大量SO2漂白银耳 |
| B.用小苏打(NaHCO3)焙制糕点 |
| C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
钠-硫(Na/S8)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+ 通过。下列有关说法错误的是()
| A.放电时b为电池的负极 |
| B.充电时阴极反应式为:Na++e—=Na |
| C.充电时,阳极处发生还原反应 |
| D.放电时Na+ 可以穿过固体电解质流向a电极 |
下列说法错误的是()
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol/L氨水中滴加0.l mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-a mol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.①④ | B.②④ | C.①③ | D.②⑤ |
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是()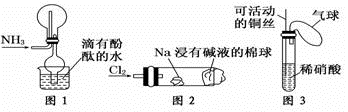
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
| A.②③④ | B.①②④ | C.①②③ | D.①③④ |