过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH
 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是 。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有 、 。
(3)过氧乙酸溶液与KI反应的离子方程式为 。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。 。
氢氧化钙俗称熟石灰,在生产和生活中有广泛的用途.
(1)熟石灰可由生石灰溶于水制得,反应的化学方程式是: .测量其溶液的pH时,可以 ,再用标准比色卡比较试纸显示的颜色,读取该溶液的pH.
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是: .
(3)用熟石灰来改良酸性土壤,反应的化学方程式是: (以土壤中含有硫酸为例).
(4)用熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合可制得高效环保农药“黑白粉”.使用时,选择有露水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体.
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的KOH,反应的化学方程式是 .
②“黑白粉”还可提供植物必需的营养素是 (填元素符号).
化学是在原子、分子的水平上研究物质及其变化规律.请回答下列关于水与过氧化氢(H2O2)的问题:
(1)H2O2中氧元素的化合价为 .
(2)1个过氧化氢分子中含有 个H, 个O.
(3)写出下列反应的化学方程式:
①水通电后分解: ;
②过氧化氢分解: .
(4)下列关于它们的说法正确的是 (填编号).
①水、过氧化氢组成元素相同,化学性质也相同
②过氧化氢溶于水得到的物质仍然属于纯净物
③水是生物体内重要的组成物质
④硬水可以使肥皂水产生更多的泡沫.
阅读下面科普短文。
氮氧化物(NOx)种类很多,造成大气污染的主要是一氧化氮(NO)和二氧化氮(NO2)。NO通常为无色气体。熔点为-163.6℃,沸点为-151.5℃。它的性质不稳定,在空气中易氧化成NO2。NO结合血红蛋白的能力比CO还强,更容易造成人体缺氧。NO分子作为一种传递神经信息的信使分子,在使血管扩张、增强免疫力、记忆力等方面有着极其重要的作用。NO2通常为红棕色有刺激性气味的气体,溶于水生成硝酸(HNO3)和NO,工业上利用这一原理制取HNO3。NO2能使多种织物褪色,损坏多种织物和尼龙制品,对金属和非金属材料也有腐蚀作用。城市大气中的NOx大多来自于化石燃料的燃烧。经测算,天然气、煤和石油燃烧产生NOx的量分别为:6.35 kg/t、8~9 kg/t、9.1~12.3 kg/t。以汽油、柴油为燃料的汽车,尾气中NOx的浓度相当高。在非采暖期,北京市一半以上的NOx来自机动车排放。
依据文章内容,回答下列问题:(各答1条即可)
(1)分别说明NO的“利与弊”:“利”是___________________,“弊”是
___________________。
(2)NO2溶于水发生反应的化学方程式是_________________________________。
(3)与煤和石油相比,天然气是比较清洁的燃料,结合数据解释原因:______________________。
(4)减少NOx污染的有效措施是________________________________________________。
金属和金属材料在人类的生产、生活中有着重要的作用。
(1)冬天取暖用的暖气片有铸铁材料、铜铝材料等多种。这主要利用了金属的性。
(2)铁生锈的条件是,因此,铸铁暖气片通常在表面刷漆以防铁被腐蚀。
(3)生产、生活中对钢铁的需求量特别大,在炼铁炉中,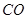 还原氧化铁的化学方程式为。
还原氧化铁的化学方程式为。
(4)新型材料纳米铁粉具有广泛的用途,它比普通铁粉更易与氧气反应,其制备的主要流程如下图所示。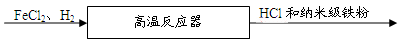
纳米级铁粉遇氧气无需加热就能燃烧,生成物的化学式为。
高温反应器中发生反应的化学方程式为。反应前需向反应器中通入氮气,目的是。
重晶石矿的主要成分为硫酸钡(BaSO4),纯净的硫酸钡才能作为医用“钡餐”。工业上用重晶石矿制硫酸钡的流程如下: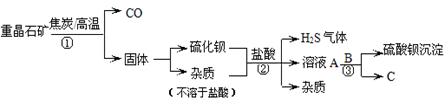
(1)步骤①中,生成的一氧化碳具有炼铁和 等用途;生成的硫化钡中硫元素的化合价为-2,写出硫化钡的化学式 。
(2)已知步骤②、③均为为复分解反应。反应②的化学方程式是 ,若C在该生产过程中可循环使用,则B的化学式是 。