重晶石矿的主要成分为硫酸钡(BaSO4),纯净的硫酸钡才能作为医用“钡餐”。工业上用重晶石矿制硫酸钡的流程如下:
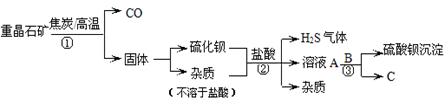
(1)步骤①中,生成的一氧化碳具有炼铁和 等用途;生成的硫化钡中硫元素的化合价为-2,写出硫化钡的化学式 。
(2)已知步骤②、③均为为复分解反应。反应②的化学方程式是 ,若C在该生产过程中可循环使用,则B的化学式是 。
酸雨主要是燃烧含硫燃料释放出SO 2 造成的。
(1)写出SO 2 形成酸雨的化学方程式。__________________________
(2)分析酸雨的pH随时间的变化情况。_________________________
下表是摘自国家环境监测中心公布的某时间我国部分大城市空气的监测周报.
| 城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
| 北京 |
92 |
TSP |
Ⅱ |
济南 |
76 |
TSP |
Ⅱ |
| 天津 |
82 |
TSP |
Ⅱ |
武汉 |
83 |
NO x |
Ⅱ |
| 长春 |
103 |
TSP |
Ⅲ |
深圳 |
77 |
NO x |
Ⅱ |
| 上海 |
74 |
NO x |
Ⅱ |
汕头 |
54 |
Ⅱ |
|
| 杭州 |
67 |
TSP |
Ⅱ |
成都 |
87 |
TSP |
Ⅱ |
| 福州 |
42 |
Ⅰ |
重庆 |
98 |
SO 2 |
Ⅱ |
|
| 厦门 |
25 |
Ⅰ |
贵阳 |
69 |
TSP |
Ⅱ |
注:TSP:空气中飘尘;NO x :含氮氧化物.
阅读分析上表,回答下列问题:
(1)经济特区中,空气质量最好的城市是_____________,直辖市中空气质量最差的城市是_____________.
(2)最容易出现酸雨的城市是_____________.为防止城市出现酸雨,降低煤燃烧时向大气排放的SO 2 ,工业上将生石灰或石灰石和含硫煤混合使用.请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式 ___________________________.
空气污染监测仪是根据SO 2 与Br 2 的定量反应测定空气中SO 2 的含量:SO 2 +Br 2 + 2H 2 O="=H" 2 SO 4 +2HBr,上述反应的溴,来自一个装满酸性KBr溶液的电解槽阳极上的氧化反应。电解槽的阴、阳极室是隔开的。当测空气中SO 2 的含量时,空气(经过除尘)以1.5×10 - 4 m 3·min - 1 的流速进入电解槽的阳极室,电流计显示每秒通过的电子是8.56×10 - 1 1mol时,此条件下能保持溴浓度恒定,并恰与SO 2 完全反应(设被测空气中不含与溴反应的物质)。
(1)写出监测过程中主要发生的化学反应方程式;_______________________。
(2)计算空气中SO 2 的含量(g·m - 3 空气)。
按下面的实验过程填空:
写出上述反应的化学方程式:
(1)______________________________________________;
(2)______________________________________________;
(3)______________________________________________。
人造纤维的原料是____________,合成纤维的原料是____________。