298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3molH2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HCl的物质的量浓度 (mol·L-1) |
BOH的物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH>7 |
请回答:
(1)从第①组情况分析,BOH是(选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)=mol·L-1。
(2)第②组情况表明,c0.2。该混合液中离子浓度c(B+)c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中(选填“<”、“>”或“=”)
甲:BOH的电离程度BCl的水解程度
乙:c(B+)—2 c (OH—)c(BOH)—2 c(H+)
图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题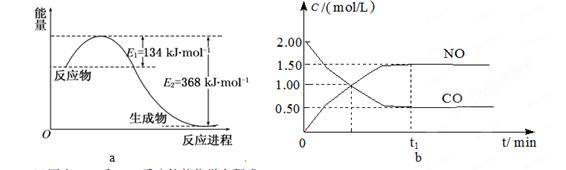
(1)写出NO2和CO反应的热化学方程式。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=。
(3)此温度下该反应的平衡常数K=;温度降低,K(填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1 mol NO2 1 mol CO |
2 mol NO 2 mol CO2 |
1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 |
1.5 |
3 |
m |
| 能量变化 |
放出a kJ |
吸收b kJ |
放出c kJ |
| CO或NO的转化率 |
α1 |
α2 |
α3 |
则:α1+α2=, a+b/2=,m=
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):;写出C与A形成的18e-化合物的电子式;
(3)用电子式表示A2C的形成过程:
(4)写出题中生成M的化学方程式
某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如下图所示。则该反应的的反应物是,生成物是,化学方程式为;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____,若不能,则其原因为 _ ________________;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____状态。
实验室用下图装置制取乙酸乙酯。
(1)加热前在大试管中加入几粒碎瓷片的作用是,
(2)导气管不能插入饱和Na2CO3溶液液面以下是为了,
(3)实验室制取乙酸乙酯的化学反应方程式为:。
(4)饱和Na2CO3溶液的作用是,,。