在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu |
| B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ |
| D.残余固体是Fe,溶液中一定不含Cu2+ |
下列有关物质浓度关系的描述,正确的是
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(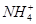 )>c( )>c(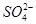 )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(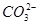 )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
c(CH3COONa)> c(Na2CO3)>c(C6H5ONa)>c(NaHCO3)
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c(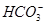 )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c(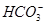 )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c(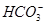 )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c(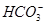 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
常温下,向20.00 mL 0.100 0 mol·L-1CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是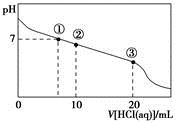
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH>c(CH3COO-) )>c(H+) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
已知H2CO3的酸性强于H2S,将a mol·L-1NaHS与b mol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
| A.a=b时:c(OH-)=c(H+)+c(HS-) |
| B.a=2b时:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S) |
常温下,下列有关醋酸溶液的叙述中不正确的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| C.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)减小 |
| D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |