某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰 ②将海带灰浸泡得其悬浊液 ③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘 ⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |
(2)过滤用到的三种玻璃仪器主要
(3)用有机溶剂将碘从水中提取出来需用到下列哪套装置 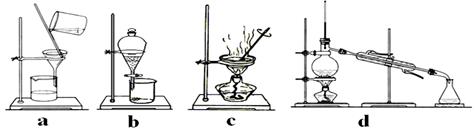
(4)若用四氯化碳作溶剂进行提取,则分层后下层物质为
(共15分)化学是以实验为基础的学科,检查装置气密性是化学实验中的重要操作之一。请按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是________(填序号,下同).
A.容量瓶 B.洗气瓶C.分液漏斗 D.酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致不良后果的叙述中,正确的是________.
A.收集不到气体 B.造成环境污染
C.观察到的实验现象有误 D.引发爆炸事故
(3)为检查如图所示简易气体发生装置的气密性,甲同学进行了以下操作和方案设计。甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他的方案可行。请补充完善甲同学的操作方案、现象和结论:_________。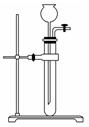
(4)化学实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(5)图是某同学在配制150 mL 0.2 mol/L NaCl溶液时转移溶液的示意图,图中的两处错误是:_________________、____________________。
若在定容时仰视,则所配溶液的浓度_________(填“偏高、偏低、不影响”)。若定容不慎超过刻度线,应采用的处理方法是:__________________。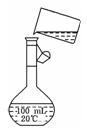
(共14分)A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
填写下列空白:
(1)物质A是,B是,B的离子结构示意图为。
(2)写出化合物E的电子式:,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示):。D溶液可以用来止血,请简单说明其止血原理是:。
(3)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是,漂白粉常用于自来水的杀菌消毒,原因是(写出反应的化学方程式,并加以适当的文字
说明):。
(4)F中加入NaOH溶液,并在空气中放置由白色变为灰绿色最后变成红褐色沉淀的化学方程式是。
、
Ⅰ、下列实验操作及实验现象或结论正确的是_________________
A用粗盐提纯精盐,滤液在蒸发皿里加热蒸干,当有少量固体析出时即停止加热
B分液操作时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C 某物质灼烧时,焰色反应为黄色,则说明该物质一定含钠元素,但不能确定该物质中一定没有钾元素
D 配制一定物质的量浓度的溶液时,将溶解在烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也要注入容量瓶
Ⅱ、如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加溶液(如图所示),然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O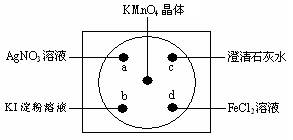
(1)用双线桥标明电子转移的方向和数目,并指出氧化产物和还原产物
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O氧化产物________还原产物__________
(2)a处观察到的现象是_________________________
(3)b处出现了先变蓝后接着蓝色又褪去的现象,其中变蓝的原因是(用离子方程式表示)_________________________________________
(4)c处反应的化学方程式是_________________________________________
(5)d处反应的离子方程式______________________________________________,检验d试剂是否变质,可选用试剂__________________
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.l mo1·L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中,难以实现之处是配制100mLpH=l的HA溶液;而不妥之处是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)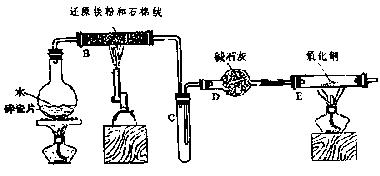
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为__ __(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
此步涉及反应的离子方程式为。经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是___________________。
D装置的作用:________________.
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: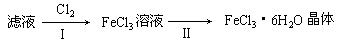
①用离子方程式表示步骤I中通入Cl2的作用(2分)
(用单线桥表示电子转移的方向和数目)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填”合理”或”不合理”)。