某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
(3)该物质溶液中逐滴加入氢氧化钡溶液至金属元素完全沉淀时的化学反应方程式 。
(4)将SO2气体通入该物质的溶液中可以观察到的实验现象是 ,写出该反应的离子方程式 。
(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。请评价该实验操作是否合理 (填“合理”或者“不合理”),理由 。
对于下列所示实验操作,完全正确是 ()
A B C
课题式课堂教学是“研究性学习”的方式之一,其基本模式为:提出课题→确定研究方案→解决问题→总结和评价。下页图是关于“CO的化学性质”的课题式课堂教学“解决问题”阶段中,甲同学设计的证明“CO具有还原性”的实验装置。
(1)气体验纯后开始进行实验,实验时应先点燃 处
(填“A”或“B”)的酒精灯。
(2)反应一段时间后,可观察到洗气瓶中的现象为 ,加热的玻璃管里的现象为 。
(3)酒精灯B的作用是 。
(4)乙同学提出甲同学设计的装置太复杂,认为可将酒精灯合二为一,去掉B,而将尾气导管口旋转到A的火焰上即可,乙同学的设计是否合理? (填“合理”或“不合理”),理由是。
(5)丙同学质疑“CO能否使澄清的石灰水变浑浊”,该同学设计CO通入CuO之前,应先通过澄清石灰水,以排除CO与澄清石灰水反应。试对此作出评价,认为丙的设计(填“必要”或“不必要”),理由是
。
(6)丁同学认为甲同学的设计的装置中的尾气处理还可以有其他的方法,请你为丁同学设计一种合理的尾气处理方法
。
实验室配制500 mL 0.1mol·L-1的氢氧化钠溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
回答下列问题:
(1)需称量g的氢氧化钠, 氢氧化钠固体应放在仪器中称量。
(2)上述步骤的正确操作顺序是(填序号)。
(3)上述实验,除用到托盘天平、500mL容量瓶 、烧杯、胶头滴管、药匙外,还用到。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: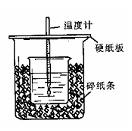
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
下表是元素周期表的一部分,回答下列有关问题: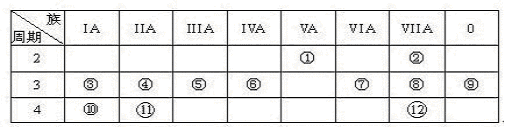
(1)写出下列元素符号:①________,⑥________,⑦________
(2)画出原子的结构示意图:④__________,⑧__________
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是()
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)第三周期(除稀有气体元素)中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号),它们可以形成(填离子或共价)化合物,用电子式表示其形成过程下:
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,该化合物是(填分子式)分子的空间构型为: