用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: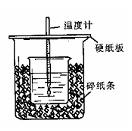
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有和。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为。
③试分析1~3min时间段里,反应速率变大的主要原因。
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm ,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)写出制备1,2-二溴乙烷的化学方程式________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是__________。
(3)容器b中NaOH溶液的作用是__________,容器d中NaOH溶液的作用是__________。
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是__________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因________________.
碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
请回答:
(1)步骤①中灼烧海带用到的实验仪器是______________________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤③的实验操作是_______________________。
(3)步骤④中反应的离子方程式是_____________________________________。
(4)步骤⑤中,可以选择的有机溶剂是__________________(填序号)。
a. 乙酸 b. 四氯化碳 c. 酒精 d. 苯
(5)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: __________________________________________________________________________。
(6)因过量的Cl2会与I2反应,所以步骤④中加入的氯水应保持适量。为证明此说法,某同学做如下实验:取少量碘水,滴加氯水,观察到碘水逐渐褪色,经检验生成物含有IO3-。该反应的化学方程式是_________________________________。
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是。
(4)一段时间后,C中白色沉淀溶解,其原因是__________________________。
(5)装置D的作用是____________________________________________。