为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。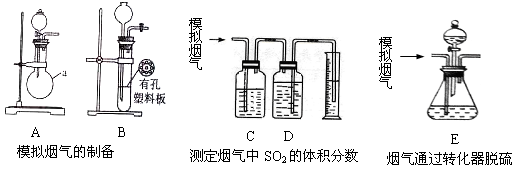
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为。
(2)用B装置制CO2,使用该装置优点的是。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是、。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+②。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经、洗涤、、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是。
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
| 物质 |
水 |
乙醇 |
乳酸 |
苯 |
乳酸乙酯 |
| 沸点/℃ |
100 |
78.4 |
122 |
80.10 |
154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石……;装上油水分离器和冷凝管,缓慢加热回流至反应完全。
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏。
(1)第一步操作中,还缺少的试剂是 ;加入苯的目的是 ;实验过程中,酯化反应进行完全的标志是 。
(2)第二步中证明“水洗”已经完成的实验方案是 。
(3)第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用 法。
(4)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有 个峰。
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是(填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是;
关于M中铁元素价态的判断正确的是(填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是(填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中 =。
=。
氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。
①生石灰应该装在(填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因:。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 |
实验操作 |
预期现象及结论(步骤1只填现象) |
| 1 |
在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 |
|
| 2 |
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04 ml,计算上述氨水的物质的量浓度
牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有
A.易溶于水 B.难溶于水 C.颗粒较大 D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
①往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式______。
②往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
① 对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:只有SiO2假设2:可能有SiO2和CaCO3
假设3:可能有________________。
② 请设计方案对B品牌牙膏摩擦剂的成分进行验证。填写下表。限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B。 |
|
| 步骤2: |
|
| 步骤3: |
(4)已知C牌牙膏中的摩擦剂为CaCO3,为测定CaCO3的质量分数,取20.0g牙膏样品溶于水后过滤,将所得沉淀溶于100mL1mol/L的盐酸(假设所得溶液体积不变),从所得的溶液中取20.00mL,用1mol/L NaOH溶液进行滴定,消耗NaOH溶液5.00mL,则C品牌牙膏中CaCO3的质量分数为_(保留四位有效数字)。.