碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
请回答:
(1)步骤①中灼烧海带用到的实验仪器是______________________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤③的实验操作是_______________________。
(3)步骤④中反应的离子方程式是_____________________________________。
(4)步骤⑤中,可以选择的有机溶剂是__________________(填序号)。
a. 乙酸 b. 四氯化碳 c. 酒精 d. 苯
(5)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: __________________________________________________________________________。
(6)因过量的Cl2会与I2反应,所以步骤④中加入的氯水应保持适量。为证明此说法,某同学做如下实验:取少量碘水,滴加氯水,观察到碘水逐渐褪色,经检验生成物含有IO3-。该反应的化学方程式是_________________________________。
某同学用下图装置做浓硫酸与木炭反应的实验,以及检验生成的CO2和SO2。已知:C中的酸性高锰酸钾溶液具有强氧化性,能吸收具有还原性的SO2气体。据此回答下列问题: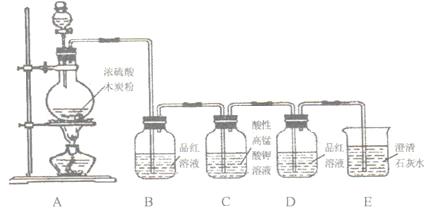
(1)木炭与浓H2SO4在加热条件下反应的化学方程式为:
(2)装置B观察到的现象是,得出的结论是
(3)装置D观察到的现象是,得出的结论是
(4)装置E观察到的现象是,得出的结论是。
该装置中发生的离子方程式是。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号),该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:;
(4)如下图是某次滴定时的滴定管中的液面,其读数为mL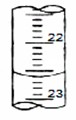
(5)根据下列数据:请计算待测盐酸溶液的浓度:mol·L-1
| 滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯(B)洁净纸片(C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用(填编号字母)作指示剂。 (A)甲基橙(B)石蕊(C)酚酞
(3)若选用甲基橙作指示剂,滴定终点的判断依据是
此时溶液显性。
(4)0.2000mol·L-1的盐酸应装在下图所示的(填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是mol·L-1。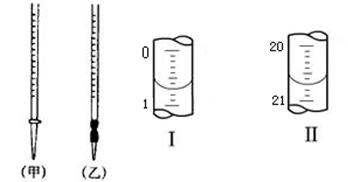
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果。
下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。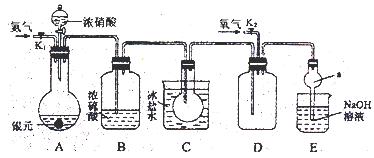
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是。
(2)若装置中缺B,其后果是。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是。
(4)C装置的作用是;E中a仪器所起的作用是。
(5)已知该银圆的质量为25g,加入75mL 12mol·L—1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2mol·L—1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL。
①参加反应的硝酸的物质的量是。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是。
我们知道“喷泉”是一种常见的自然现象,其产生的原因是存在压强差。
(1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管与烧杯中分别盛有液体。挤压滴管的胶头,下列与实验事实不相符的是()
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
(2)某学生积极思考产生喷泉的其他方法,并设计了图乙所示装置。
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是
②在图乙锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
③比较上述图甲和图乙两套装置,从产生喷泉原理来分析,图甲是上部烧瓶内压强;图乙是下部锥形瓶内气体压强(均填“增大”或“减小”)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述(填“图甲”或“图乙”)装置的原理相似。