工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡的时间/min |
达到平衡时体系能量的变化/kJ |
||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4 |
| ② |
650 |
2 |
4 |
|
|
t1 |
Q1 |
| ③ |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 |
(1)计算容器②中反应的平衡常数K=_____________(计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为____________。
(3)容器①中反应达平衡这段时间,化学反应速率 =__________。
=__________。
(4)该反应的正反应为_______(填“吸热”或“放热”)反应,理由是____________。
(5)下列叙述正确的是____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2>Q1>32.8kJ
c.达到平衡的时间:t2>t1>2.5min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol
(本题6分)
⑴电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是 __,证明Fe3+存在的现象是 __。[来]②写出FeCl3溶液与金属铜发生反应的化学方程式:。
⑵ 3Cl2+ 6NaOH ="=" 5NaCl + NaClO3+ 3H2O
氧化剂与还原剂的物质的量之比为,氧化产物是 ________。
室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E是无色溶液,F是淡绿色溶液。B和C反应发出苍白色火焰。请回答:(本题9分)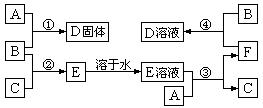
(1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式______________________________;
(3)反应③的离子方程式______________________________;
(4)反应④的离子方程式______________________________。
写出下列反应的化学方程式或离子方程式:(本题8分)
⑴氯化铁溶液中加入铁粉
化学方程式:____________________________________
⑵碳酸氢钠溶液滴入盐酸中
离子方程式:________________________________________
⑶碳酸氢钠溶液和氢氧化钠溶液反应
化学方程式:________________________________________
⑷将二氧化碳通入炽热的炭层
化学方程式:________________________________________
填写下列空格(本题3分)
| 化学反应方程式 |
氧化剂 |
还原剂 |
| Zn + 2HCl = ZnCl2 + H2↑ |
||
| 3NO2 + H2O= 2HNO3+ NO |
||
C+H2O(气)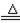 CO+H2 CO+H2 |
在CaCO3、CO2、CO、Na2CO3、NaHCO3、Cl2物质中(本题3分)
⑴大气中过多会造成温室效应的是_______________.
⑵俗名是小苏打,且是制糕点发酵粉的主要成分的是________
⑶能和血液中血红蛋白结合而使人中毒的是_________________
⑷是水垢的主要成分_______________
⑸能用于制造漂白粉的是__________________
⑹俗名是纯碱,工业上用于造纸业的是___________