氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:

①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式,试剂M为溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是;
②已知3Cl2 +2 NH3 =" 6HCl" + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为,反应一段时间后,关闭b打开c,观察到的现象为;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: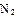 +3
+3
 2
2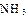 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为;
②右图中在状态A时,平衡常数 KA(填写代入数值
的表达式,不要求算出具体数值);当温度由T1变化到T2时,
KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
反应从0 min到3 min之间,H2的反应速率为;反应在3 min时,条件发生了改变,改变的条件可能是(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分
子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性。
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是 ;
(2) 在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平),1 mol C2A4参加反应转移电子的数目为,氧化产物的化学式为;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为;
(4)用X、D2 和能传导O2-的的固体电解质组成的原电池中,负极的电极反应式为。
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂。则这种有香味的有机物在一定条件下水解的化学方程式是。
某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① +IBr →
+IBr →
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
⑴已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用▲,用方程式表示碘瓶必须干燥的原因▲。
⑵步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是▲。
⑶步骤Ⅲ中所加指示剂为▲,滴定终点的现象▲。
⑷反应结束后从液体混合物中回收四氯化碳,则所需操作有▲。
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是▲(填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是▲。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为▲。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有▲。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为▲;该晶体的化学式为▲。