硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程如下.
回答下列有关问题:
(1)硼砂中B的化合价为_________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为________,MgCl2•7H2O脱水需要在HCl氛围中加热,其目的是________。
(3)硼氢化钠是一种常用的还原剂,它与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑。硼氢化钠在溶液中能把许多金属离子还原为金属单质,为了抑制它与水的反应,反应应在_______(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:
_____Au3++____BH4-+_____OH-═___Au↓+______BO2-+____ ______。
(12分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H 键断裂,则形成的π键有mol。
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为。
(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。该反应的化学方程式:。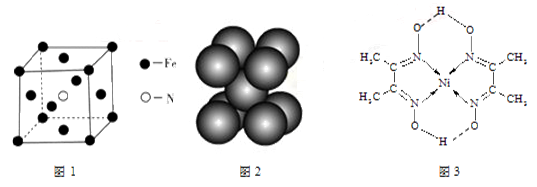
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是。
a.常温下N2很稳定,是因为N的电负性大
b.钠晶胞见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有(填序号);
a.极性共价键b.非极性共价键c.配位键 d.氢键
Y中碳原子的杂化方式有。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H ="b" kJ/mol (II)
2ClNO(g) K2∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示),∆H=kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示),∆H=kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)=mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2(填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。若改用AlCl3水溶液作电解液,则阴极产物为。
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下: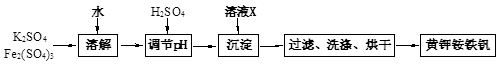
(1)溶液X是。
(2)检验滤液中是否存在K+的操作是。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
(1)酸浸时发生的反应的离子方程式为;为提高BaCO3的酸浸率,可采取的措施为(任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是。
(3)加入H2C2O4溶液时,发生反应的化学方程式为;
可循环使用的物质X是。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、和。
[物质结构与性质]乙烯酮 (CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到。也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到。
(1)Zn2+基态核外电子排布式为。
(2)与H2O互为等电子体的一种阴离子为;乙烯酮分子中碳原子杂化轨道类型有。
(3)CH3COOH的沸点比HCOOCH3的高,其主要原因是。
(4)lmol(C2H5O)3P=O分子中含有的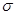 键的数目为。
键的数目为。
(5)Ag的氧化物的晶胞结构如图所示,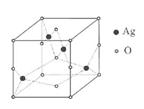
该氧化物的化学式为 .