氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2 2NH3,则在电化学合成氨的过程中,阳极反应式为 ,阴极反应式为 。
2NH3,则在电化学合成氨的过程中,阳极反应式为 ,阴极反应式为 。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
| t/K |
298 |
398 |
498 |
…… |
| K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试确定K1的相对大小,K1 4.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(NH3)(正) =3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为( )
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]
(1)按系统命名法填写下列有机物的名称: 的名称是____________________。
的名称是____________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________,1 mol该烃完全燃烧需消耗氧气________mol。
A、B、C、E四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示: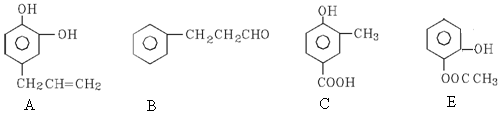 :
:
请回答下列问题:
(1)写出A与足量Br2水反应的化学方程式________________________________________。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 _ (用A、B、C填空)。
(3)按下图B经一步反应可生成D,D和A的互为________________________,写出B与新制的Cu(OH)2悬浊液反应的化学方程式:_________________。
(4)写出E与足量NaOH溶液共热反应的化学方程式:_________________________。
(14分)Ⅰ.用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)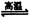 Si3N4(s)+12HCl(g)ΔH <0
Si3N4(s)+12HCl(g)ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________;
(2)上述反应达到平衡后,下列说法正确的是__________。
A.其他条件不变,压强增大,平衡常数K减小
B.其他条件不变,温度升高,平衡常数K减小
C.其他条件不变,增大Si3N4物质的量平衡向左移动
D.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_____。
A.3v逆(N2)= v正(H2)B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变D.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___m:n(填“>”、“=”或“<”)。
Ⅱ.铬是人体必需的一种微量元素,但是铬过量摄入对人体造成的危害非常大。目前对含铬废水的处理通常是将毒性较强的六价铬转化为毒性较弱的三价铬。某工业废水中含有一定量的Cr2O72—和CrO42—,处理方法之一为“还原沉淀法”,该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色) + 2H+ Cr2O72—(橙色) + H2O
Cr2O72—(橙色) + H2O
(1)若平衡体系的pH=2,则溶液显色。
(2)能说明第①步反应达平衡状态的是。
A.c(Cr2O72—)= c(CrO42—)
B.2v(Cr2O72—) =v(CrO42—)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—,需要_______mol的FeSO4·7H2O。
(1)已知:M(g)+N(g) P(g)+W(g)ΔH>0,请回答下列问题:
P(g)+W(g)ΔH>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为。
A、加入一定量M
B、加入一定量N
C、反应温度升高
D、缩小容器体积
E、加入某物质作催化剂
F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=。
(2)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1mol CO2和3mol H2
③ a.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1277 kJ·mol-1
b.2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1
c.C(s)+1/2O2(g)=CO(g)ΔH=-110.5 kJ·mol-1
d.H2O(g)=H2O(l)ΔH=-44 kJ·mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=________。
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变),HI浓度的变化正确的是(用图2中a-c的编号回答)。
②若加入I2,则H2浓度的变化正确的是(用图2中d-f的编号回答)。