研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)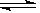 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)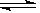 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)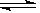 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。(保留2位小数)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)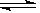 CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_________(填元素名称)。
(2)根据元 素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaC l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
(4)由叠氮酸钠(NaN3)热分解可得光谱纯N2:2NaN3(s)===2Na(l)+3N2(g),下列有关说法正确的是 (选填序号)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.金属钠的晶胞结构如图所示,每个晶胞平均分摊2个钠原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
请根据题意回答下列 问题:
问题:
Ⅰ、当甲烷的四个氢被甲基替换后,得到新戊烷,新戊烷的所有氢原子再被甲基替换得到新的烷烃,……
(1)请写出甲基电子式。
(2)新戊烷的三氯代物有种同分异构体。
(3)试写出甲烷按上述方法连续进行三次甲基替换操作后所得烷烃的分子式
Ⅱ、分子式为C7H16的烃为手性分子,在核磁共振氢谱中有6个吸收峰,则该烃分子的结构简式为_______;其系统命名法的名称为______。
Ⅲ、现有CH4、C2H2、C3H4、C3H8 四种气态烃,回答下列问题(填分子式):
(1)当这四种气态烃质量相同时,分别在氧气中完全燃烧,消耗O2的量最多的是_____;生成水的量最少的是_____。
(2)在120℃,101Kp时,取上述气态烃中的某一种烃1L和3L过量的氧气在密闭容器中完全燃烧,恢复到原来的状况,测得燃烧后气体的总体积仍是4L,则该烃是____________。
水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
( 2)已知2H2O
2)已知2H2O  H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以 作还原剂;
作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH 均为7;
均为7;
⑥水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定 性:沸点:
性:沸点:
水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为。(原子量Ca:40,O:16,H:1)
在800℃时,2L密闭容器内,2NO(g)+O2(g) 2NO2(g)反应体系中,n(NO)随时间的变化如表:
2NO2(g)反应体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。
已知: >
>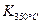 ,则该反应是热反应。
,则该反应是热反应。
(2)上图中表示NO2的变化的曲线是;
用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2 )b.容器内压强保持不变
)b.容器内压强保持不变
c.v逆(NO)=2v正(O2 )d.容器内密度保持不变
)d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂