水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
( 2)已知2H2O
2)已知2H2O  H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以 作还原剂;
作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH 均为7;
均为7;
⑥水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定 性: 沸点:
性: 沸点:
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各小题:
⑴反应达到平衡时,平衡常数表达式K=______,升高温度,K值____(填“增大”、“减小”、“不变”)。
⑵在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________________。
(用上图中出现的字母表示)
⑶在 其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的
其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的 是______________________。
是______________________。
a.氢气的浓度减小b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加d.重新平衡时n(H2)/n(CH3OH)增大
⑷据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
⑸能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22. 7kJ的能量,写出甲醇燃烧热的热化学方程式__________。
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0
CO2(g)+H2(g) ΔH <0
已知CO的浓度变化如图所示。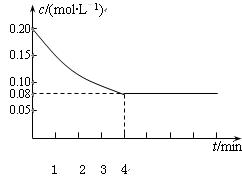
⑴从0~4 min,该反应的平均速率v(CO)=mol/(L·min)。该反应的平衡常数为。
⑵为了增大CO的转化率,可以采取的措施有。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为mol/L。
已知:A是石油裂解气的主要成份,能使溴水褪色;A是一种重要的化工原料,它的产量通常用来衡量一个国家石油化工水平。现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示:
请回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出E的结构简式。
(4)写出下列反应的化学方程式并指出反应类型:
①反应类型;
②反应类型。
热值指在一定条件下每克物质完全燃烧所放出的热量,(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。
| 物质 |
H2 |
CO |
CH4 |
| 热值/kJ·g–1 |
143 |
10 |
56 |
(1)根据以上热值数据,最理想的燃料是。
(2)根据以上热值数据,写出在该状态下氢气燃烧的热化学方程式。
(3)若管道煤气(含体积比为1:1的H2和CO)价格为1.00元/m3,天然气的价格为2.50元/m3,使用哪种气体在经济上更为合算?理由是。(无需写出计算过程)
A、B、C、D四种元素均为短周期元素,其原子半径依次减小,它们的气态氢化物分子所含的电子数相同,C元素原子的K层电子数与M层电子数之和等于L层电子数。根据以上信息,按要求写出以下化学式(用A、B、C、D所代表的真实元素符号表示)。
(1)A的最高价氧化物;(2)B的气态氢化物;
(3)C的最高价氧化物的水化物;(4)D的单质。