肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是: 。电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为 ,
则肼-空气燃料电池理论上消耗的空气 L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为 。
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
双原子分子单质在标准状况下密度为1.429g/L |
| Z |
单质及其化合物的焰色反应为黄色 |
| W |
W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于晶体。
(2)X与Y中电负性较强的是(填元素符号);XY2的电子式是,分子中存在的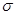 键和
键和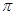 键的个数比是。
键的个数比是。
(3)Z2Y2中含有的化学键类型有;W的基态原子核外电子排布式是。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4(aq) ="=" ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) ="=" 2H2O(l) + O2(g)ΔH= -196.4kJ·mol-1
③H2(g)+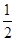 O2(g) ="=" H2O(l)ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l)ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):。
下表是元素周期表的一部分,回答下列有关问题: 1
1
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(均写出物质的化学式)
X、Y、Z、T为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数Y<Z<X<T,则
(1)元素符号XYZT;
(2)写出X的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式;
(3)按碱性减弱酸性增强的顺序,写出各元素最高价氧化物对应水化物的化学式为
A、B、C、D、E五种元素在周期表里的位置如下表所示:A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。
D元素名称是,在周期表第周期,第族,其原子结构示意图。
A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是,B―是,C是______,D是______。