选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 |
E.蒸馏法 F.过滤法
(1)分离饱和食盐水与沙子的混合物________。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾________。
(3)分离水和汽油的混合物________。
(4)分离四氯化碳(沸点为76.6℃)和甲苯(沸点为110.6℃)的混合物________。
(5)从碘的水溶液里提取碘________。
五种有机物A、B、C、D、E,其中A、B是烃类,其它为含氧衍生物;A与E、B与D分别碳数相同。常温常压下A为气体,B、C是液体,D为固体。已知:
(1)A可以聚合;完全燃烧1molA,需氧气3mol。
(2)B的蒸气对氢气的相对密度是39,完全燃烧7.8g B,需氧气16.8L(标准状态)。
(3)C与浓硫酸共热得A,C经氧化可得E。
(4)D溶液遇FeCl3溶液显紫色,E与Na2 CO3溶液混和有气体产生。
CO3溶液混和有气体产生。
由上述推断出各物质的结构简式:
A._________、B.___________、C.__________、 D.___________、E.____________。
(1)卤代烃的用途十分广泛。卤代烃(填“能”或“不能”)跟硝酸银溶液反应生成卤化银沉淀。分子式为C3H7Br的卤代烃,其结构简式有两种,分别为
和,它们与NaOH醇溶液反应生成的有机物的结构简式为。为了检验这 种有机物,可把它通入盛有的试管中。
种有机物,可把它通入盛有的试管中。
(2)分子式为C4H10O,属于醇的同分异构体有种,其中一种不能氧化成醛或酮,它的结构简式是;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式。
命名下列物质或根据题意写出结构简式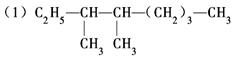 的系统命名法名称是。
的系统命名法名称是。
⑵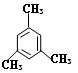 的名称是。
的名称是。
(3) 2-甲基-1-丁烯的结构简式 ,
,
(4) 相对分子质量为72且沸点最低的烷烃的结构简式。
(1)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为;该金属元素的相对原子质量为。
(2) 已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比.
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸铜溶液的反应
②碳酸钠和足量稀硫酸的反应
(2)根据下列离子方程式,各写一个符合条件的化学 方程式
方程式
①Fe+2H+====Fe2++H2↑
②HCO3-+ H+====CO2↑+ H2O