命名下列物质或根据题意写出结构简式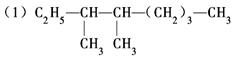 的系统命名法名称是 。
的系统命名法名称是 。
⑵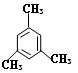 的名称是 。
的名称是 。
(3) 2-甲基-1-丁烯的结构简式  ,
,
(4) 相对分子质量为72且沸点最低的烷烃的结构简式 。
(5分)现有CH4、C2H2、C2H4、C2H6、C3H6五种有机物,等质量的以上物质中,在相同状况下体积最大的是___________;同质量的以上物质完全燃烧时耗去氧气的量最多的是_______;同状况、同体积的以上五种物质完全燃烧时耗氧量最多的是_______;等质量的以上五种物质完全燃烧时,生成二氧化碳最多的是_______,生成水最多的是_______。
理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的极,材料是,该极上出现的现象是,写出该电极的反应式。
(2)a可能为
A、铜 B、银 C、铁 D、石墨
(3)c溶液是
A、CuSO4溶液 B、AgNO3溶液 C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为克。
图是元素周期表的框架,依据元素周期表回答下列问题:
(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示),周期表中的元素④和元素⑦的氢化物的沸点高低顺序是(用化学式表示)。
(2)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写化学式)。
(3)①和②的单质在一定条件下转化为化合物A,请写出该反应的化学方程式,及A的结构式。
(4)②和硅形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是,与该化合物晶体类型相同的是______(请用相应的编号填写)。
(5)请写出工业上用电解饱和食盐水制备⑦单质的化学方程式。
下列物质:① 与
与 ;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;对各组物质的性质进行分析,并用数字序号回答问题:
;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;对各组物质的性质进行分析,并用数字序号回答问题:
(1)互为同素异形体的是,(2)互为同分异构体的是,
(3)互为同位素的是,(4)属同一物质的是。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) =" 13" mol,n t (NH3) =" 6" mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。