铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。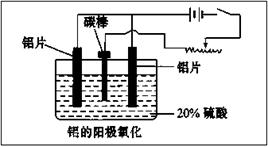
(3)下列说法正确的是 。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
有A、B、C、D四种含硅元素的物质,它们能发生如下反应:
①C与烧碱反应生成A和水;②A溶液与钙盐溶液反应生成白色沉淀D;
③B在空气中燃烧生成C;④C在高温下与碳反应生成单质B。
根据上述变化,完成下列问题:
(1)写出B、D的化学式:B、D。
(2)写出C与烧碱反应的化学方程式:。
写出A溶液与钙盐溶液反应的离子方程式:。
【化学—选:3:物质结构与性质】 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。 请回答:
请回答: (1)A元素的名称是;
(1)A元素的名称是; (2)B元素原子核外运动状态不同的电子数为,C元素原子价电子层的电子排布图为,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B元素原子核外运动状态不同的电子数为,C元素原子价电子层的电子排布图为,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是 (3)元素E在周期表中的位置是,它的+2价离子的电子排布式为:
(3)元素E在周期表中的位置是,它的+2价离子的电子排布式为:
(4)由以上五种元素的任意两种形成的常见化合物中,所含离子键成分最多的可能为 (5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。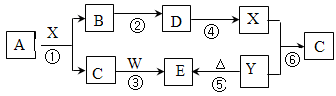
据此回答下列问题:
(1)物质W中所含有的化学键类型为,其阴、阳离子个数比为。
(2)物质C的结构式为。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出C和W反应的化学方程式:。
(6)请写出X和 Y反应的离子方程式:。
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=;H2的转化率w(H2) =。
②该反应的平衡常数表达式K=。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质有___________;其负极的电极反应式是:______________。
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳。然后使得到的氢气和一氧化碳在充足的空气中燃烧。
这两个过程的化学方程式为:
a.C(s)+ O2(g) = CO2(g)△H=E1①
b.C (s) + H2O(g) = CO(g)+ H2(g)△H=E2②
H2(g)+  O2(g) = H2O(g)△H=E3③
O2(g) = H2O(g)△H=E3③
CO(g)+  O2(g) = CO2(g)△H=E4④
O2(g) = CO2(g)△H=E4④
(1)途径b相比途径a有较多的优点,请写出其中一点:_____;
(2)上述四个热化学方程式△H>0的是___________(填写序号);
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为。