实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。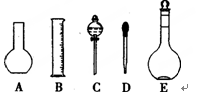
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
由A、D、E、G四种微粒组成的复盐W的化学式为xAaDd·yE2D·zG。4.704gW溶于水得一澄清的弱酸性溶液,其中溶质总量为3.408g。同质量的W与5.13g氢氧化钡充分混匀后加热,生成的气体以足量铝盐溶液充分吸收得Al(OH)3 0.624g,加热后的残渣用水充分溶解后过滤,滤液以酚酞为指示剂用0.400mol/L H2SO4滴定至终点,用去H2SO4 15.0mL,滴定完毕后,溶液中检测不出任何金属离子和酸根离子;滤渣用硝酸洗涤时部分溶解,得一遇石炭酸显紫色的黄色溶液,依据推理和计算判断:
(1)依次写出D、E、G三种微粒符号________、_______、_________;
(2)a、d的比值为_________;
(3)复盐的化学式为________。(写出计算步骤)
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
元素X基态原子的p电子比s电子少1个。元素Y基态原子的2p电子是2s电子的2倍。元素Z的一种单质为自然界硬度最大的物质。元素M位于第四周期,其基态原子失去3个电子后3d轨道半满。
(1)X、Y、Z的基态原子,第一电离能由大到小的顺序是。
(2)X的氢化物易于液化,其原因是。
(3)X与M形成的一种化合物晶胞结构如图所示。
①每个晶胞中M离子的数目为;
②该化合物的化学式为。
(4)Y可形成单质Y3
①Y3分子的空间构型为(用文字描述)。
②写出一种与Y3互为等电子体的分子的化学式:。
(5)Y、Z的化合物ZY可与M的单质生成配合物M(ZY)5,该配合物中σ键与π键的个数比为。
氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:
则H2还原NO生成氮气和水蒸气的热化学方程式是:
。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为。上述反应的平衡常数表达式K=。200℃时该反应的平衡常数K=64.8,则该反应的△H0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为。
②甲与水反应可得H2,其化学方程式是:
。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式:。
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式。
(2)将酸浸的尾气循环利用,加入的X气体可以是。
(3)流程中加入ZnO调pH的目的是。
(4)滤渣2中的成分是。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级。
(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下: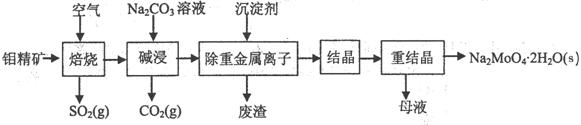 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果: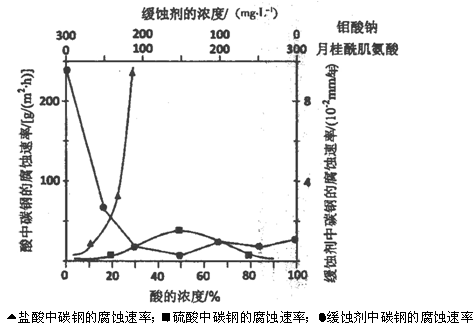
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。