纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
写出下列物质在水中的电离方程式。
(1)H2S____________________________________________
(2)Fe(OH)3______________________________________
(3)NaHCO3________________________________________
(4)NaHSO4_________________________________________
(5)复盐能完全电离,如KAl(SO4)2____________________________________________
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,请完成下列问题: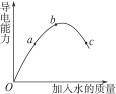
(1)图中O点时导电能力为0,其理由是_________________________________________。
(2)a、b、c三点对应溶液的c(H+)由小到大的顺序为_______________________________。
(3)a、b、c三点对应溶液中,醋酸电离程度最大的是______________________________。
(4)试说明醋酸的导电能力与加水量变化的原因:_________________________________。
在一定温度下冰醋酸加水稀释的过程中,溶液的导电能力如图3-2所示,请完成下列问题:
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
如图所示的试管中盛的是较浓的氨水,氨水中因加有酚酞而显浅红色。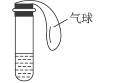
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是___________(有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)对加热后的试管放入约20 ℃的水中冷却,观察现象,试管中的溶液里有明显的现象,它是_______________________________。
如图3-1所示,在密闭容器里盛有饱和H2S溶液和H2S气体。
(1)饱和H2S溶液中存在的分子有____________,离子有______________________________。
(2)若将容器顶盖由a压到b位置,则H2S溶液中,各离子浓度的变化情况是________离子浓度增大,而________离子浓度减小。
(3)若从c处不断通入过量的SO2气体,溶液中H+浓度将( )
| A.不断增大 | B.先减小,后增大到某值 | C.不变 | D.先增大,后减小到某值 |
(4)若由c处不断通入N2,则溶液中H+浓度将________。(填“变大”“变小”或“不变”)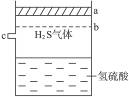
图3-1