在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,请完成下列问题: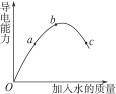
(1)图中O点时导电能力为0,其理由是_________________________________________。
(2)a、b、c三点对应溶液的c(H+)由小到大的顺序为_______________________________。
(3)a、b、c三点对应溶液中,醋酸电离程度最大的是______________________________。
(4)试说明醋酸的导电能力与加水量变化的原因:_________________________________。
下表为长式周期表的一部分,其中的编号代表对应的元素。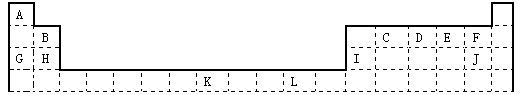
试填空。
(1)写出元素D与A形成的化合物的电子式,该化合物分子的空间构型是,其中元素D的杂化方式为。
(2)J的离子结构示意图;K元素在周期表的位置。元素L基态原子的电子排布式。
(3)E、H、I 这三种元素的第一电离能由大到小的顺序是(填对应的元素符号);
(4)由D、J的氢化物相互作用所生成的物质所含化学键有下列的。
A、离子键
B、非极性键
C、极性键
D、金属键
E、配位键
(5)用氢键表示式写出F的氢化物水溶液中所有氢键
铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: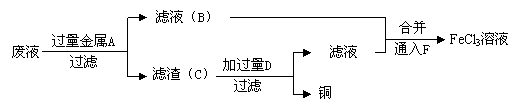
①滤渣C的化学式为;
②试剂F宜选用______(填选项序号),通入F的目的是_______________;
A.酸性KMnO4溶液B.氯水C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)=。
X2是人体呼吸中不可缺少的气体,Y是地壳中含量最多的金属元素,Z元素的焰色为黄色,W2是一种黄绿色气体。请回答下列问题:
(1)写出Z的元素符号,画出X的原子结构示意图;
(2)工业上利用W2和消石灰制取漂白粉,则漂白粉的有效成分是;
(3)Z元素组成的两种盐A、B在一定条件下可以相互转化,A、B都可与足量盐酸反应且产物完全一样,其中A是发酵粉的主要成分之一,则B通过化合反应转化为A的化学方程式;
(4)工业上是通过电解Y2X3冶炼Y单质,若生成了0.1 mol Y单质,则转移mol电子;
(5)今有MgSO4和Y2(SO4)3的混合溶液,已知c(SO42-)=1.5mol·L-1。则溶液中c(Y3+)=mol·L-1。其中,往一定体积该混合溶液中加入Z单质的物质的量与生成沉淀的物质的量的关系如图:
(1)写出Na2CO3在水溶液中电离的电离方程式。
(2)在3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O的反应中,作为氧化剂的物质是(填化学式);用双线桥法,标出该氧化还原反应的电子转移情况和数目。
(3)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O由以上反应可知RO3n-被(填“氧化”或“还原”), RO3n-中元素R的化合价是。
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)在一个密闭容器中,发生反应:C(s)+H2O(g)  CO(g)+H2(g)则该反应正向反应是:反应(填:放热、吸热),该反应化学平衡常数表达式为K=,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) (填:不变、变大、变小)。
CO(g)+H2(g)则该反应正向反应是:反应(填:放热、吸热),该反应化学平衡常数表达式为K=,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) (填:不变、变大、变小)。
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇(CH3OH)。
①已知在常温常压下:2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)∆H = -566.0 kJ/mol
H2O(g)=H2O(1)∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从(填“c”或“b”)口通入,电池负极反应式为_______________________________。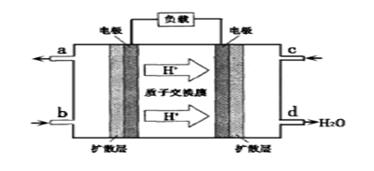
(3)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g) ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是______________。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,0.5分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=________mol/(L•min),若继续通入0.20mo1SO2和0.lmolO2,则达平衡时SO2的转化率_______(填“不变”、“增大”“减小”)
(5)25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。