铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: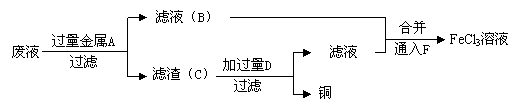
①滤渣C的化学式为 ;
②试剂F宜选用______(填选项序号),通入F的目的是_______________;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)= 。
某反应中反应物与生成物有:
、
、
、
、
、
和一种未知物质
。
 (1)已知
在反应中得到电子,则该反应的还原剂是。
(1)已知
在反应中得到电子,则该反应的还原剂是。 (2)已知0.2
在反应中得到1
电子生成
,则
的化学式为。
(2)已知0.2
在反应中得到1
电子生成
,则
的化学式为。 (3)根据上述反应可推知。
(3)根据上述反应可推知。 a.氧化性:
〉
b.氧化性:
a.氧化性:
〉
b.氧化性:
 〉
〉
c.还原性:
〉
d.还原性:
 〉
〉
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方 向和数目:
向和数目:
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:

①该反应的平衡常数表达式为:
②该温度下,在2 盛有 粉末的密闭容器中通入 气体,10后,生成了单质铁11.2 。则10 内 的平均反应速率为
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态: ①②
①② (3)某些金属氧化物粉末和
粉在镁条的引燃下可以发生铝热反应。下列反应速率(
)和温度(
)的关系示意图中与铝热反应最接近的是。
(3)某些金属氧化物粉末和
粉在镁条的引燃下可以发生铝热反应。下列反应速率(
)和温度(
)的关系示意图中与铝热反应最接近的是。

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
(4)写出氢氧化铝在水中发生酸式电离的电离方程式: 欲使上述体系中
浓度增加,可加入的物质是。
欲使上述体系中
浓度增加,可加入的物质是。
环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。



完成下列填空: (1)写出反应类型:反应①反应③
(1)写出反应类型:反应①反应③
 (2)写出结构简式:
(2)写出结构简式:
 (3)写出反应②的化学方程式:
(3)写出反应②的化学方程式:
 (4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含
(4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含 及
及 结构)有种。
结构)有种。
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质),H溶液具有强氧化性、强酸性。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)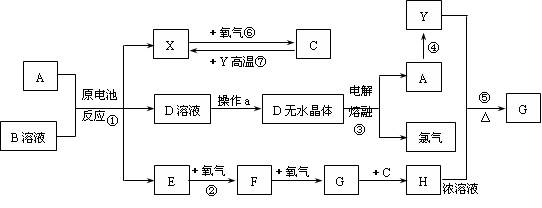
请填写下列空白:
(1)反应④为A在二氧化碳中燃烧,生成黑色固体单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为。
(6)A在元素周期表中有位置是:第_________周期、第__________族。
(7)Y的同素异形体有__________、___________、____________等。
在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
(1).升高温度,v正v逆
(2).加入催化剂, v正v逆
(3).充入更多的H2 , v正v逆
(4).取出一定量的I2 , v正v逆 (5).增大容器的体积, v正v逆
(5).增大容器的体积, v正v逆
(6).容器的体积不变,通入氖气, v正v逆